細胞外からの情報を伝達する新しいメカニズムを解明- X線結晶構造解析により明らかになった受容体の活性化機構 -(プレスリリース)
- 公開日
- 2002年09月20日
- BL41XU(構造生物学I)
平成14年9月20日
理化学研究所
|
理化学研究所(小林俊一理事長)は、科学技術振興事業団(JST)および東京大学理学部と共同で、細胞外から細胞内への情報伝達にかかわるタンパク質の立体構造を原子レベルで決定し、新しい分子メカニズムを解明することに初めて成功しました。理研横浜研究所ゲノム科学総合研究センター(和田昭允センター所長)タンパク質構造・機能研究グループの横山茂之プロジェクトディレクターらの研究グループによる成果です。 (論文) |
1.背景
細胞における情報分子の作用機構の解明は、生物の複雑で多様な情報を処理する高度な情報処理システムを理解する上で極めて重要な課題です。例えば増殖因子受容体は、細胞外領域への増殖因子の結合という刺激によって細胞膜を横切る情報を細胞内に伝達する必要があります。多くの研究結果から、増殖因子の結合による刺激は、受容体が会合することによって、その情報が細胞内へ伝達されると考えられています。
上皮細胞成長因子(EGF)は1962年にCohenらにより新生マウスの眼瞼(まぶた)開裂、切歯出現を促進する因子として雄マウス顎下腺抽出物から単離されたポリペプチド性細胞増殖因子です。EGFは、細胞膜を貫通する糖タンパク質であるEGF受容体に結合し、その作用を発現します。EGF受容体は、種々の上皮組織に存在しており、1984年にEGF受容体遺伝子とトリ赤芽球症ウイルスのもつ発がん遺伝子V-erbBとの相同性が指摘され、増殖因子受容体型の発がん遺伝子の存在が示されました。さらに扁平上皮がんでEGF受容体遺伝子の増幅と再配列、受容体タンパク質の過剰発現、グリオーマでは細胞外ドメインの部分欠損によりチロシンキナーゼが恒常的に活性化されたEGF受容体の産生が観察され、発がんにEGF受容体が直接関与することが示されています。
また、EGF受容体ファミリーに属するErbB2(HER2)分子は、幅広い腫瘍の症例において遺伝子増幅や転写レベルでの発現増強が認められています。さらに、乳がんにおける臨床症例の解析でErbB2発現腫瘍の予後が非発現症例に比して悪い傾向が報告されており、腫瘍の悪性化形質維持にも重要な役割を果たしていると考えられています。
EGF受容体は、単一ポリペプチドから成り、N末端側は、リガンド結合部位を有する細胞外領域、続く23残基は、1回貫通型の膜貫通領域を形成しています。C末端側はチロシンキナーゼ活性をもつ細胞内領域を形成しており、リガンドの結合によって受容体が会合し、結果としてチロシンキナーゼが活性化されます。生物にとって本質的な細胞増殖にかかわる情報伝達のメカニズムを理解するために、EGF受容体ファミリーをターゲットとして、15年以上も前から現在に至るまで、その細胞外ドメインの会合構造を明らかにする試みがなされてきました。
2.研究の手法
ヒトのEGF受容体は、分子質量約170 kDa※1の膜貫通型糖タンパク質です。このうちリガンド※2依存的に受容体の会合を引き起こす細胞外領域は、約95kDaの糖タンパク質です。今回、研究グループでは、ヒトEGFと結合することによって会合したヒトEGF受容体細胞外領域の立体構造解析に取り組みました。
X線によって立体構造を決定するためには、EGFとEGF受容体との複合体の結晶を作成しなければなりません。これまでもEGFとEGF受容体との複合体の結晶は報告があるものの、X線構造解析に成功した結晶を作製することはできませんでした。その原因は、タンパク質に付加した糖鎖の不均一性にあると考えられていました。そこで、チャイニーズハムスター卵巣細胞の糖鎖合成遺伝子変異株である「Lec8細胞」を用いて、目的とするタンパクを産生させ、さらに酵素的に糖鎖を切断することによって、より均一でX線構造解析に適した結晶を再現性よく得ることに成功しました。また、Lec8細胞を用いたタンパク産生系においてはじめて、多波長異常分散(MAD)法※3に必要な解析タンパクへのセレノメチオニン導入にも成功しました。構造決定にあたっては、大型放射光施設(SPring-8)の共用ビームラインの一つである構造生物学IビームラインBL41XUを用い、結晶のX線回折データを収集しました。BL41XUは、タンパク質の立体構造を解くためのMAD法に適しているばかりでなく、最も高輝度の放射光を有しているため、EGF受容体の結晶のように、溶媒含量が多く、結晶が十分大きいにもかかわらず、X線回折強度の弱い結晶の回折データ収集に適しています。
3.立体構造の解析結果から明らかになったこと
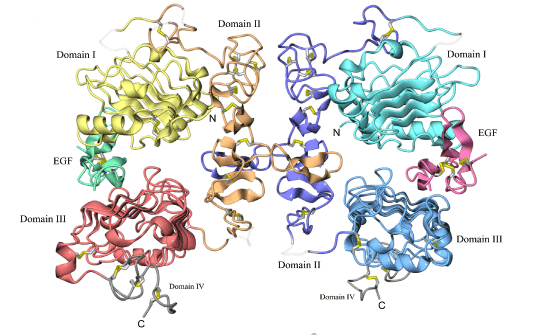
SPring-8の高輝度なシンクロトロン放射光を用いて、3.3 Å※4という分解能のX線回折データを得ることができました。精密に決定された2分子のEGFを結合した2分子EGF受容体の立体構造は、受容体から伸びたアーム様の構造が、お互いの“からだ”をつかむように2量化しているという極めて特徴的な構造をとっていることが分かりました。さらに、得られた立体構造の解析結果から、EGFが結合するEGF受容体の部位が特定され、以下のようなリガンド依存的受容体の会合メカニズムが明らかとなりました。
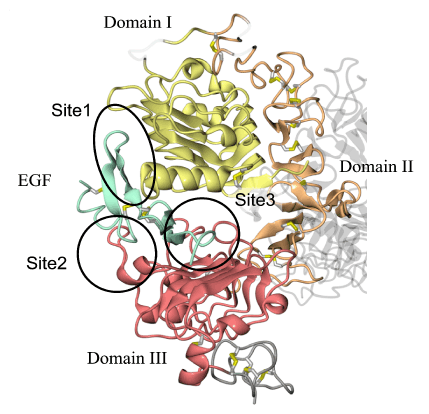
- 1)EGFは、EGF受容体の3ヶ所を認識して結合していることが分かりました。EGF受容体細胞外領域のドメインI上の1ヶ所(site1)、ドメインIII上の2ヶ所(site2、3)と結合することによって、EGF受容体細胞外領域の全体構造は、ドメインI、IIとIIIがC字型の配向をとることが明らかとなりました。今回示されたEGFとEGF受容体の結合部位は、これまで蓄積されてきた種々の生化学データと一致するものでした。
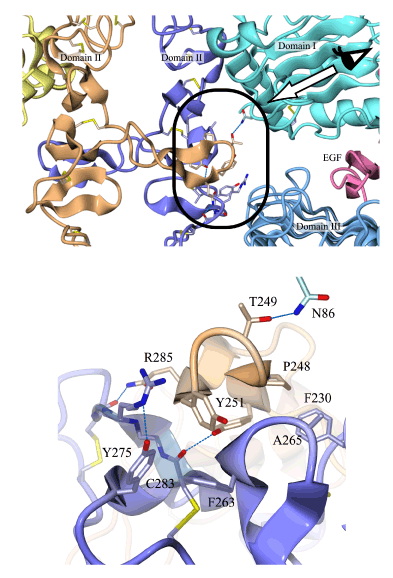
- 2)EGFを結合したEGF受容体は、ドメインIIから伸びたアーム様構造によってお互いの身体をつかむように2量化していました。このような受容体を介した2量化のメカニズムは、これまでに報告されたどの増殖因子受容体の会合構造とも異なる特徴的なものでした。しかも2量化に関わる受容体アミノ酸残基は、ErbB2をはじめとするEGF受容体ファミリーの中でも保存されており、EGF受容体ファミリーに共通の2量化メカニズムであることが予想されました。
- 3)このようなEGF受容体に特徴的な会合構造から、リガンド結合が誘導する受容体分子の配向変化によって引き起こされる、新たな受容体会合メカニズムが明らかにされました。
4.今後の展開
受容体による細胞外からの情報を伝達するプロセスは、生物の複雑な情報ネットワークが機能するための最初のステップとなるものです。従って、EGFを結合したEGF受容体の構造を原子レベルで解明したことは、受容体による情報伝達の多様なメカニズムを理解する道を開いたものといえます。今後研究グループでは、さらに、種類の異なる情報伝達タンパク質の立体構造解析を行い、細胞情報処理システムの全ぼうを明らかにしていく予定です。また、今回得られた知見を生かして、EGF受容体ファミリーのかかわる悪性腫瘍などの克服に向けた新たな治療薬および治療法の開発につなげるべく、研究を進めています。
《参考資料》
(大きさは1x0.2x0.2mm)
ドメインごとに色を変えて表示してある。2つのEGF分子は、複合体の反対側にそれぞれ結合している。ドメインIVは、ディスオーダーしていてほとんど見えない。
3ケ所の部位で結合している。それらをsite1, 2, 3と命名した。
EGFレセプターのドメインIIから伸びたアーム様構造が互いの“からだ”をつかむように2量化している。上図の矢印の方向から見た詳細図を下に示した
|
問い合わせ先: 横浜研究所 研究推進部 丸山 亮介 |
|
<補足説明> |
| ※1 Da(ダルトン) 質量を示す単位。12C原子1個の質量を12Daとする。分子量を用いることが適当でない、タンパク質複合体などの質量を表すのに用いられる。 ※2 リガンド 受容体に結合する特異的因子。受容体を活性化し情報を伝達する。 ※3 多波長異常分散(MAD)法 MAD法とは、X線の波長を変えられる放射光を使って、波長に依存した原子のX線散乱の変化に基づいて解析する方法。これまでは、原子量の大きい金、白金、水銀などでラベルした質のよい結晶が複数種必要だったが、MAD法ではただ一つのラベルされた結晶を使った解析が可能になる。ただし、これによって測定できる信号は微小なため、これまでの方法より数段も精度の高い測定が必要となる。 ※4 Å(オングストローム) 一般的には長さの単位を示す。1 オングストロームは 1 x 10-10 メートル(= 0.1 ナノメートル)。X線結晶構造解析においては、高次構造の解像度を示す単位として用いられる。数字が小さいほどより高解像度の立体構造であることを示す。 |
- 現在の記事
- 細胞外からの情報を伝達する新しいメカニズムを解明- X線結晶構造解析により明らかになった受容体の活性化機構 -(プレスリリース)