プラスミドDNAの維持に関与する蛋白質複合体の構造を解析- バクテリアの細胞死を誘導する新規抗生物質の開発のターゲット -(プレスリリース)
- 公開日
- 2005年08月19日
- BL41XU(構造生物学I)
平成17年8月19日
独立行政法人理化学研究所
本研究成果のポイント
・バクテリアのトキシンとアンチトキシンの複合体構造とトキシン蛋白質単独の立体構造の決定
・アンチトキシンによるトキシンの構造変化とそのRNA切断機構の解明
・院内感染原因菌に対抗する新たな抗生物質の開発が期待される
|
独立行政法人理化学研究所(野依良治理事長)は、プラスミドDNA※1がバクテリアの中で安定に維持保守される機構に関与する蛋白質複合体の立体構造を決定し、その分子メカニズムを解明しました。理研中央研究所花岡細胞生理学研究室の花岡文雄主任研究員、鎌田勝彦先任研究員による研究成果です。 (論文) |
1.背 景
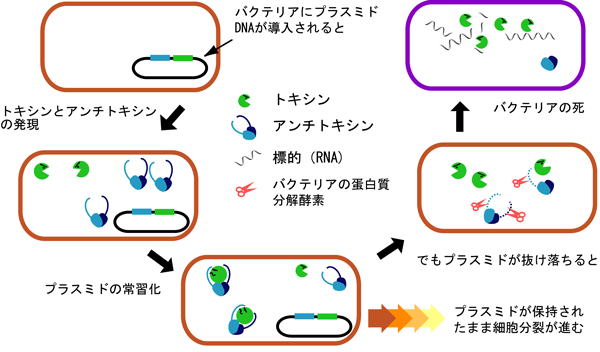
大腸菌などのバクテリアは小型の環状DNAであるプラスミドを保持しています。そのDNAが細胞分裂を通じて維持される仕組みがあり、トキシン(毒)とアンチトキシン(解毒剤)の二種類の蛋白質によって制御されます(図1)。まずバクテリアに入ったプラスミドはトキシンとアンチトキシン蛋白質を同時に供給します。これらは通常安定な複合体を形成し、トキシンの活性を抑えています。しかし、細胞分裂が進む過程で、プラスミドを保持しないバクテリアが生じると、不安定なアンチトキシンが宿主バクテリアの有する蛋白質分解酵素によって徐々に分解され、比較的安定なトキシンが活性化されて、生存に必要な機能を阻害して細胞死を誘導します。その結果、プラスミドを保持しているバクテリアだけが生き残っていきます。
一部の腸球菌※3では、様々な抗生物質耐性遺伝子を自身のプラスミドに取り込み、このような二種類の蛋白質を使って、そのプラスミドを維持し続ける戦略をとっています。このため、ほとんどの抗生物質が効かないバクテリアの繁殖が院内感染を引き起こし、社会問題となっています。アンチトキシン蛋白質の不安定性と、トキシン蛋白質のバクテリアへの毒性を分子構造的に理解することが、様々な抗生物質耐性遺伝子を持つプラスミドをコントロールすることにつながります。
2.研究手法と成果
近年のバクテリアゲノムの研究から、バクテリア染色体にもトキシンとアンチトキシンの二種類の遺伝子セットがいくつも存在することが明らかになりました。我々は、大腸菌の遺伝子産物であるYoeB(トキシン)とYefM(アンチトキシン)の蛋白質複合体とYoeB蛋白質単独の結晶を作製し、X線結晶解析によって立体構造を決定しました。これらの蛋白質は、バンコマイシン耐性遺伝子だけでなく様々な抗生物質耐性遺伝子を持つ腸球菌のプラスミドのものとよく似ており、プラスミドDNAがコードするトキシン−アンチトキシンも同様な分子メカニズムで働いていると考えられます。
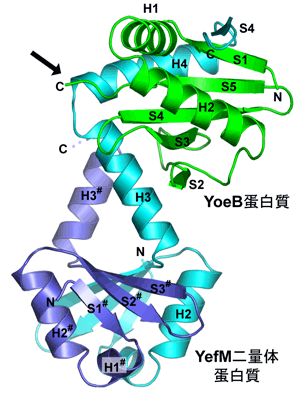
構造解析の結果、YoeB-YefM複合体は1:2の組成で構成される三量体を形成していました(図2)。YoeBはRNA※4を切断する酵素(リボヌクレアーゼ※5)と似ていましたが、予測される活性部位の構造は大きく異なっていました。一方、YefMは以前に報告されたことのない新規の構造を取っていました。YefM二量体構造の一方の分子は片方を支えるのに徹し、支えられた方はその末端のペプチド鎖でYoeBを包み込むように結合するという、極めてユニークな複合体構造をしていました。
様々な遺伝学的および生化学的実験結果から、YoeBには実際にリボヌクレアーゼ活性があり、グアニンとアデニン塩基の3’側を切断することが明らかとなりました。また、RNA切断に関与するYoeBのアミノ酸も特定することが出来ました。
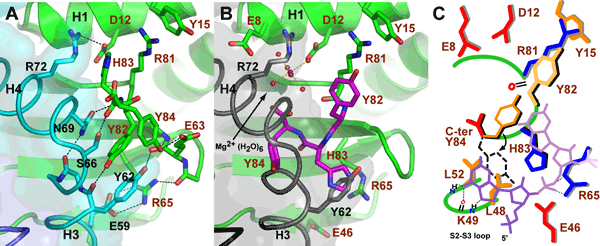
さらにYoeB単独の構造解析の結果、YoeBの活性部位の構造はバクテリアの分泌型リボヌクレアーゼSaなどに見られる典型的なコンフォメーションを有していたことから、YefMはYoeBの活性部位の構造を積極的に変化させることで、そのリボヌクレアーゼ活性を阻害していることが分かりました(図3AとB)。これらの構造的情報に基づいて、YoeBがどのようにグアニンとアデニン塩基を認識してRNA鎖を切断するのかを理解することが出来ました(図3C)。
3.今後の期待
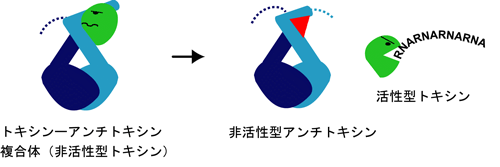
このようなトキシンとアンチトキシン蛋白質を用いた制御系は、抗生物質の耐性遺伝子を獲得したバクテリアだけを選択的に生き残らせるように働いています。構造的にトキシンとアンチトキシン複合体の形成を阻害することで、トキシンのRNA切断活性を上昇させ、バクテリア自身の細胞死を誘導出来ると考えられます(図4)。特に、アンチトキシンに注目した新しい概念の抗生物質の開発は、感染菌治療への利用が大いに期待出来ると考えています。
<参考資料>
矢印の方向は図3に示すYoeB活性部位の視点を示した
(A)YefM結合型構造。
(B)YefM非結合型構造。黒と灰色で示したYefMは比較のために示した。
(C)RNAが切断されるときの活性部位のモデル図。
<用語解説>
- ※1 プラスミドDNA
宿主であるバクテリアのゲノムDNAとは物理的に独立して自律複製し、安定に存在できる遺伝因子。
- ※2 抗生物質
微生物が産生し他の微生物の増殖を抑制する物質がその定義であったが、現代は天然物を起源とするものだけでなく全合成物をも定義として含めている。その恩恵は人間の営みの中で計り知れないが、近年バクテリアが抗生物質を分解し無毒化する因子を獲得し、抗生物質の効かない耐性菌の出現が問題となっている。
- ※3 腸球菌
ヒトや動物の腸の常在菌で全ての人が多かれ少なかれ持っている。一部のものではあるが、バンコマイシン(メチシリン耐性黄色ブドウ球菌(MRSA)の治療に用いられる抗生物質)に対し耐性を獲得している。それらは臨床治療に汎用されている抗生物質が効かない場合が多く、院内感染症の原因となっている。
- ※4 RNA
リボ核酸の総称。DNAの遺伝情報は一度、RNAに転写され,それが蛋白質に翻訳される。
- ※5 リボヌクレアーゼ
RNA分解酵素。RNA鎖を切断する様式は様々だが、一本鎖または二本鎖RNAを末端から順に切断するエキソヌクレアーゼタイプと、真ん中から切断するエンドヌクレアーゼタイプとに大別される。YoeBトキシンの場合、一本鎖RNAを真ん中から切断する。
|
<本研究に関する問い合わせ先> (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- プラスミドDNAの維持に関与する蛋白質複合体の構造を解析- バクテリアの細胞死を誘導する新規抗生物質の開発のターゲット -(プレスリリース)