DNAの複製開始反応を制御するメカニズムの解明(プレスリリース)
- 公開日
- 2007年11月13日
- BL26B1(理研 構造ゲノムI)
- BL41XU(構造生物学I)
- BL44B2(理研 物質科学)
平成19年11月13日
京都大学
|
京都大学大学院理学研究科 三木 邦夫教授、中村 顕研究員は、元京都大学ウイルス研究所 和田 千惠子助教授(現・株式会社吉田生物研究所、京都大学大学院生命科学研究科 研究顧問)、理化学研究所播磨研究所との共同研究で、DNA複製開始反応を制御するRepEタンパク質の立体構造の決定に世界で初めて成功し、その制御機構を解明しました。 本研究成果の詳細は、 米国科学誌「米国科学アカデミー紀要(Proceeding of the National Academy of Sciences USA (PNAS))」誌2007年11月12日−16日の週の電子版に掲載されます。 (論文) |
1. 研究の背景
DNAの複製反応は、生命が生存しその遺伝情報を子孫へ伝えるために最も根元的で必要不可欠な生体反応の一つです。ヒトなどの高等生物と同じように細菌でも、DNA複製の開始反応が適切な時期と適切な場所で起こるような仕組みが存在しています。例えば、大腸菌内で自律複製されるFプラスミドの複製開始反応はRepEタンパク質の働きによって厳密に制御されています。このRepEタンパク質は単独の分子として存在する(単量体である)時には複製開始反応を導く働きをしますが、二つの分子が会合する(二量体となる)とその機能を失うことが知られています。そして普段は二量体として安定な状態にあり、RepEタンパク質自身が合成されないように働きかけています。こうしてタンパク質分子の会合状態に依存した二つの機能を合わせ持つことで、RepEタンパク質はFプラスミドの複製開始反応を制御しています。以前に研究グループではRepEタンパク質が二分子会合することなく単量体で存在できる変異体を利用して、結合するDNAとの複合体での立体構造を決定しました(図1左)。これまでに、この複製開始活性を持つ単量体と活性を持たない二量体の間には大きな立体構造変化が予想されていましたが、二量体状態の立体構造が未知であったため、RepEタンパク質の二量体から単量体への変換機構、すなわちRepEが複製開始タンパク質として機能するための分子機構が分かっていませんでした。
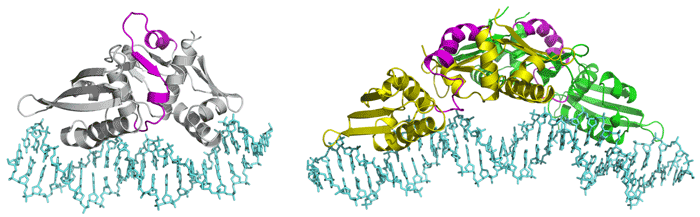 図1:RepEタンパク質の立体構造。左は単量体型の変異体RepEタンパク質とDNAの複合体、
図1:RepEタンパク質の立体構造。左は単量体型の変異体RepEタンパク質とDNAの複合体、右は今回構造解析に成功した二量体型RepEタンパク質とDNAの複合体。マゼンタ色で示したのはドメイン間リンカー。
2. 研究成果の概要
研究グループでは、大腸菌Fプラスミドの複製開始タンパク質RepEの二量体と結合するDNAとの複合体を結晶化し、大型放射光施設(SPring-8)の構造生物学ビームラインBL41XU、理研構造ゲノムビームラインIBL26B1、理研構造生物学ビームラインIBL44B2を利用してその立体構造を決定し(図1右)、その解析結果を用いて、単量体と二量体の立体構造を比較しました。以前に決定した単量体の立体構造からはRepEタンパク質が二つのドメインとそれらを繋ぐリンカーから構成されることが明らかになっていましたが、今回の二量体の構造でもその構成要素は保存されていました。特に、二つのドメインにおいてはアミノ酸の側鎖に至るまで立体構造が保持され、驚くほど似た構造をしていました。しかしながら、二つのドメインを繋ぐリンカーの立体構造が異なっており、それに伴って、二つのドメインの相対配置が大きく変化していました(図2)。また、このリンカー周辺にRepEタンパク質の二量体から単量体への変換反応を促進する分子シャペロンとよばれる他のタンパク質が作用することが予想されました。 これらのことから、複製開始不活性な二量体RepEタンパク質のドメイン間リンカーに分子シャペロンが働きかけ、リンカーの構造が柔軟になるとともに二つのドメイン間の相対配置が変化することで、複製開始活性のある単量体へと変換されるというメカニズムが示唆されます。このように、本研究成果により、DNA複製開始を司るRepEタンパク質の分子会合による機能制御の機構が明らかになりました。
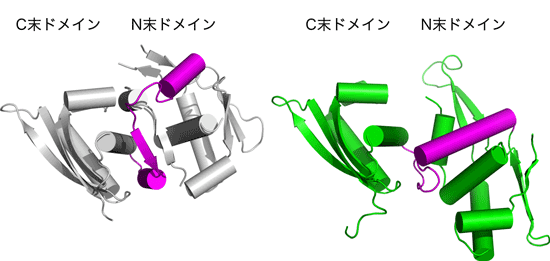 図2:単量体と二量体の間の立体構造変化。左は単量体、右は二量体を構成する一分子のみ。
図2:単量体と二量体の間の立体構造変化。左は単量体、右は二量体を構成する一分子のみ。マゼンタ色で示したリンカーの構造が変化しており、それに伴ってドメインどうしの相対配置が変わっている。
図中ではC末ドメインの位置に対してN末ドメインの位置が大きく異なっている。
|
<問い合わせ先> (研究内容に関すること) (SPring-8全般に関すること) |
- 現在の記事
- DNAの複製開始反応を制御するメカニズムの解明(プレスリリース)