植物が光を感じる分子メカニズムの一端を解明 ― 光屈性を担う青色光受容タンパク質フォトトロピン光受容ドメインの構造解析に成功 ―(プレスリリース)
- 公開日
- 2008年08月21日
- BL41XU(構造生物学I)
- BL44B2(理研 物質科学)
2008年8月21日
慶應義塾大学
公立大学法人大阪府立大学
財団法人高輝度光科学研究センター
独立行政法人理化学研究所
本研究成果のポイント
○ 植物青色光受容タンパク質フォトトロピン1およびフォトトロピン2の光受容ドメインLOV(光・酸素・電圧;Light-Oxygen-Voltage感受性)1の立体構造を決定
○ 生体内シグナル伝達に関わるタンパク質相互作用様式について新たな知見
|
慶應義塾大学(塾長 安西祐一郎)、公立大学法人大阪府立大学(理事長・学長 南努)、財団法人高輝度光科学研究センター(理事長 吉良爽)、独立行政法人理化学研究所(理事長 野依良治)は共同で、植物の光屈性など光合成の効率化にかかわるさまざまな生理反応をつかさどる青色光受容タンパク質のフォトトロピン1とフォトトロピン2の光受容ドメインの1つである、LOV1の立体構造を解明しました。解析の結果、いずれのフォトトロピンのLOV1ドメインも二量体※1を形成しており、フォトトロピン分子が植物の細胞内でLOV1ドメインを介した二量体として存在することが強く示唆され、LOV1ドメインの結合様式が2種類のフォトトロピン間で異なることが明らかになりました。この結果、フォトトロピンの光感受性を担うLOV1ドメインの結合様式が、フォトトロピン1と2の光強度感受性を制御している可能性がでてきました。今回の成果によって、植物の生育にとって重要な役割を果たす青色光受容の分子基盤の一端が解明されたことになります。さらにLOVドメインが、生体内シグナル伝達に関わるタンパク質間相互作用部位に見られる主要なドメイン構造であるPASドメイン※2ファミリーに属することから、今回の構造解析結果は、生体内シグナル伝達におけるタンパク質間相互作用様式について新たな知見を付け加えました。 (論文) |
1.背 景
植物は、動物の目に対応する感覚器官を持っていませんが、発芽、生長、開花などさまざまな生理反応が光によってコントロールされています。光合成を行う植物にとって、光は特に重要な環境情報です。植物は、光合成活性の効率化を図るために、ミクロからマクロなレベルでの多様で巧妙な仕組みをもっています。一番よく知られているのは光屈性(phototropism)で、これは葉の受光面積を広げるためのマクロなレベルの応答です。“進化論”で有名なチャールズ・ダーウインも植物が光に対して屈曲性を示すこと、それに青色光が良く効くことを報告しています。その後、青色光を受容している実体がタンパク質であると明らかになったのは100年以上の時を経た1997年で、この青色光受容タンパク質はフォトトロピン(phototropin)と名付けられました。フォトトロピンは細胞レベルでは、光合成の効率を決めている炭酸ガスの取り込みを行う気孔の開口の光制御を行い、さらにミクロな細胞器官レベルでは、葉肉細胞中の葉緑体の位置を光環境によって動かし、受光面積を拡大したり光による葉緑体の損傷を避けたり(葉緑体光定位運動)して、光合成活性の効率化を行っています。
フォトトロピンは約1,000個のアミノ酸からなり、光を受けるための小分子(フラビンモノヌクレオチド)を2つ結合しています。フォトトロピン分子はフラビンモノヌクレオチドを結合して光受容を担うLOVと呼ばれるドメインを2つ(LOV1、LOV2)とシグナル伝達に関わるキナーゼ(タンパク質リン酸化酵素)ドメインをもち(図1)、青色光により活性制御される酵素として働くと考えられています。多くの種子植物のような高等植物には、2種類のフォトトロピン(フォトトロピン1とフォトトロピン2)が存在します。上記の光屈性、葉の伸展運動、気孔開口、葉緑体光定位運動などの光制御において、フォトトロピン1が弱光から中強光の広い光強度範囲の、フォトトロピン2が中強光から強光域の青色光センサーとして働くこと、さらにいくつかの機能を役割分担していることなどが明らかになっています。その際にLOV2ドメインがキナーゼ活性の光制御分子スイッチとして働き、LOV1ドメインが光感受性制御にかかわることが示唆されていました。これらフォトトロピンの機能を理解するためには、その分子構造、とりわけ立体構造の解明は必須です。光感度調節などを効率よく行うためには、分子が単量体※1ではなく多量体※1で存在する方が有利です。研究グループはこのLOV1に注目し、その分子構造の解明を試みました。
2.研究手法と結果
現在、全長フォトトロピンを人工的かつ大量に作りだす技術が確立されていないため、部分構造の解析からその全容に迫る戦略で構造生物学的研究が進行しています。研究グループでは、フォトトロピン1、フォトトロピン2の光受容LOV1ドメインの立体構造を明らかにするために、X線結晶構造解析の手法を用いて各LOV1ドメインの立体構造を解析しました。最初に、植物の細胞生理学的研究で多用されているシロイヌナズナ由来のフォトトロピン1、フォトトロピン2のLOV1ドメインを組み換え大腸菌で発現させて精製したのち、結晶を得ました。
得られた結晶は、いずれも多結晶であり、回折強度測定に困難を極めました。フォトトロピン1LOV1ドメインについては、大型放射光施設SPring-8※3の理研構造生物学 II ビームラインBL44B2を用いて、多結晶から切り出した太さ0.02 mmの細い結晶にX線を照射して回折X線測定を行いました。一方、フォトトロピン2のLOV1ドメイン結晶は多結晶性が高く、単結晶領域の切り出しが不可能でした。そのため、構造生物学 I ビームラインBL41XUでしか利用できない0.03 mm径のX線ビームを結晶性のよい領域に照射して回折X線測定を行いました。これらの工夫を通じて、各LOV1ドメインの立体構造を2.0~2.1 Å(オングストローム)という高分解能※4で決定することができました(図2)。
SPring-8の構造生物学 II ビームラインBL40B2で過去に行ったX線小角散乱実験からは、いずれのLOV1ドメインも水溶液中で二量体を形成することが明らかとなっていましたが、その会合※5構造を引き起こす構造基盤が数個のアミノ酸残基と会合形成界面に取り込まれた水分子であることが、今回の結晶構造解析で明らかとなり、全長のフォトトロピンが生体内で二量体構造を有することが強く示唆されました。さらに、研究グループでは、LOV1ドメインに遺伝子操作をほどこして、特定のアミノ酸残基の改変がLOV1ドメインの会合を妨げてしまうことも示すことができ、どのアミノ酸残基が会合の鍵となっているのかが明らかになりました。
生体内では、外部からの物理化学的刺激がタンパク質間の相互作用によって伝達されていますが、その伝達機構によく利用されているタンパク質の部分構造としてPASドメインと呼ばれる構造が知られています。同種のPASドメインの会合、異種のPASドメインの会合が、生体内シグナル伝達や遺伝子発現制御に利用されています。今回結晶構造解析を行ったLOV1ドメインは、その立体構造がPASドメインに属することから、PASドメイン会合体形成の構造的特徴を分類するとともに、一般的なPASドメインの会合機構についても言及することができました(図3)。
3.今後の展開
フォトトロピンの構造・機能の詳細を知るためには、フォトトロピン全長の結晶構造解析が不可欠であり、今回の研究成果を基に、LOV2ドメインとシグナル伝達ドメインも含めた構造解析から、植物の青色光による個体制御の分子基盤の全容を解明することが待たれています。同時に、今回の成果は、植物細胞内、細胞間に存在する分子間相互作用を介した“光情報ネットワーク”による植物個体制御の分子機構解明に弾みをつけるものと期待されています。さらに、このような光受容分子の構造解析は、生体分子を利用したナノ光センサー開発にも役立つと考えられています。
<参考資料>
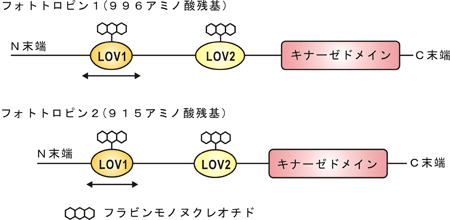 図1.フォトトロピン1、フォトトロピン2アミノ酸配列上の機能単位の位置
図1.フォトトロピン1、フォトトロピン2アミノ酸配列上の機能単位の位置N末端(アミノ末端)からC末端(カリボキシル末端)までの間が1つのアミノ酸配列を示します。小分子フラビンモノヌクレオチドはLOVドメインに1分子ずつ結合しています。今回の結晶構造解析では矢印で示したLOV1領域の結晶構造を明らかにしました。
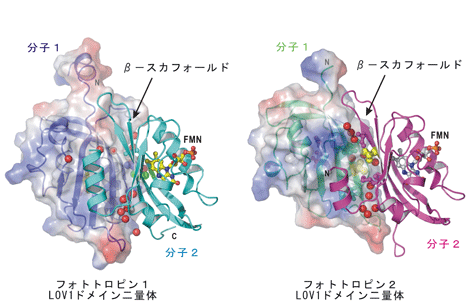 図2.フォトトロピン1(左図)、フォトトロピン2(右図)の光受容LOV1ドメイン二量体の立体構造(大きさは約40Å)
図2.フォトトロピン1(左図)、フォトトロピン2(右図)の光受容LOV1ドメイン二量体の立体構造(大きさは約40Å)立体構造はリボンモデルによって模式的に表示し、二量体を構成する分子ごとに色分けしてあります。片方のドメインには表面構造が重ね合わせて描いてあります。赤い球は、二量体化に寄与している水分子です。いずれのLOV1ドメインもβ-スカフォールド(タンパク質の2次構造の1種)と呼ばれる特徴的な立体構造と水分子の相互作用によって二量体を形成しています。フラビンモノヌクレオチド(FMN)は棒モデルで表示してあります。
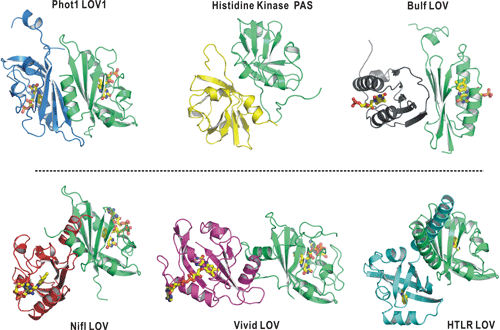 図3.さまざまなPAS/LOVドメイン二量体の会合形態比較
図3.さまざまなPAS/LOVドメイン二量体の会合形態比較光受容や生体内シグナル伝達経路で見いだされたPAS/LOVドメインは、多くの場合、二量体を形成します。これまでに知られていたPASドメインの会合形態に、今回の結果を加味すると、その会合形態は大きく分けて、β-スカフォールドを会合面に利用する場合(Phot1 LOV1, Phot2 LOV1, Histidine Kinase PAS, Bulf LOVなど上段の分子群)、タンパク質の端に存在するα-ヘリックス構造(タンパク質の2次構造の1種)を会合面にする場合(Vivid LOV, HTLR LOV、Nifl LOVなど下段の分子群)、の2通りに大分類できることがわかりました。PASドメインの生体内シグナル伝達における会合形態をアミノ酸配列から推定する大きな助けとなります。
<用語解説>
※1 二量体、単量体、多量体
タンパク質が2本のアミノ酸の鎖(ポリペプチド鎖)から構成される場合、そのタンパク質を二量体という。同様に、ポリペプチド鎖が1本の場合は単量体、2本以上の場合は多量体という。
※2 PASドメイン
生体内シグナル伝達経路で見出されるタンパク質群の総称。代表的な3つのタンパク質(Period clock protein、Aryl hydrocarbon receptor nuclear translocator、Single-minded protein)の頭文字から名づけられた。例えば、Period clock proteinは、ショウジョウバエの生物時計をつかさどるタンパク質。
※3 大型放射光施設SPring-8
理化学研究所が所有する兵庫県にある大型共同利用施設で、その管理運営は高輝度光科学研究センターが行っている。SPring-8の名前はSuper Photon ring-8GeVに由来する。ほぼ光速で進む電子が、その進行方向を磁石などによって変えられると接線方向に赤外線や可視光線、紫外線やX線などを含む電磁波が発生する。これが放射光であり、電子のエネルギーが高く、進行方向の変化が大きいほど、X線などの短い波長を含むようになる。第三世代の大型放射光施設と呼ばれるものには、世界にSPring-8、APS(アメリカ)、ESRF(フランス)の3つがある。
※4 高分解能
Å(オングストローム:1×10-10メートル(=100億分の1メートル))の単位を用いて表し、この数字が小さいほど分解能が高く、より精度の高い解析であることを示す。
※5 会合
ポリペプチド鎖同士が、水素結合や分子間相互作用などの非共有結合的な相互作用で寄り集まること。
|
(問い合わせ先) 公立大学法人大阪府立大学大学院 (SPring-8に関すること) (報道担当) 公立大学法人大阪府立大学 独立行政法人理化学研究所 広報室 報道担当 |
- 現在の記事
- 植物が光を感じる分子メカニズムの一端を解明 ― 光屈性を担う青色光受容タンパク質フォトトロピン光受容ドメインの構造解析に成功 ―(プレスリリース)