ストレスに対する防御応答のバランスを保つ機構の一端を解明 −タンパク質合成を調節する「Hfq」の分子機構が明らかに−(プレスリリース)
- 公開日
- 2013年11月07日
- BL32XU(理研 ターゲットタンパク)
2013年11月7日
独立行政法人理化学研究所
本研究成果のポイント
• 「Hfq」と有害な過酸化水素を分解する「カタラーゼ」が複合体を形成することを発見
• Hfqの働きを制御し、ストレス応答タンパク質の合成量を調節する新規機構を発見
• 不明だったHfqが関与するタンパク質制御機構解明へ重要な知見
|
理化学研究所(理研、野依良治理事長)は、生物が持つストレスに対する防御応答のバランスを保つ機構の一端を、大腸菌を用いた実験によって発見しました。これは、理研放射光科学総合研究センター(石川哲也センター長)利用技術開拓研究部門米倉生体機構研究室の米倉功治准主任研究員、渡邊真宏特別研究員(現 産業技術総合究所 研究員)、影山裕子テクニカルスタッフ、生物試料基盤グループの眞木さおり研究員らの研究グループによる成果です。 (論文) |
背 景
生物は、温度変化、活性酸素、紫外線などのストレスに晒されると、いろいろなストレス応答タンパク質の合成量を調節して、生きのびるため防御の応答を行います。例えば、細菌を富栄養環境で育てると、エネルギー代謝が増え、活性酸素である過酸化水素が大量に発生し細胞にストレスを与えます。この時、細胞内では、カタラーゼという過酸化水素を分解する酵素が増産され、過酸化水素は速やかに水と酸素に分解されます。
タンパク質は、DNAの塩基配列がメッセンジャーRNA(mRNA)に写しとられ(転写)、順番にアミノ酸が重合し合成(翻訳)されます。この過程で、Hfqと呼ばれるリング状のタンパク質と小さなRNA分子(sRNA[4])がmRNAと相互作用し、mRNAの安定性とタンパク質への翻訳活性の調節を行います。Hfqの仲間はヒトから細菌まで広く存在し、いずれもmRNAやsRNAなどのRNAと結合してその3次元構造を安定化させる機能を持っています。
ストレス環境下では、HfqとsRNAは、RNA合成酵素[5]のシグマ因子[6]の1つRpoSの配列情報が転写されたmRNAと作用し、RpoSの合成を促進させます。合成されたRpoSはRNA合成酵素に結合し、DNA上でカタラーゼの遺伝子を認識して、そのmRNAの合成を促します。その結果、カタラーゼのmRNAの翻訳が進み、カタラーゼの合成量は上昇します。カタラーゼは、有害な過酸化水素を分解するため、細胞内の環境の恒常性はストレス環境下でも保たれることになります。
このように、Hfqは、カタラーゼを含むさまざまなタンパク質合成に関与していることは知られていますが、その詳細な分子機構については、ほとんど分かっていませんでした。
研究手法と成果
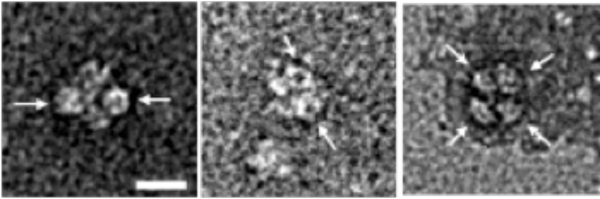
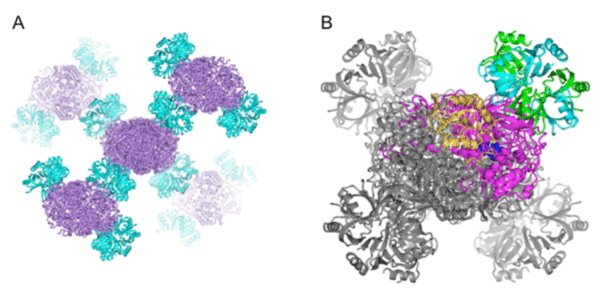
研究グループは、ストレスを与えた環境で大腸菌を生育し、ストレス環境下において多量に合成されるタンパク質を同定しました。その結果、カタラーゼとHfqの合成量の増加が確認できました。得られた試料を電子顕微鏡で観察したところ、カタラーゼにHfqが結合した大きな複合体が見つかりました(図1)。この複合体の結晶を作成し(図2)、大型放射光施設「SPring-8」のX線ビーム(ビームラインBL32XU)を用いてその立体構造を解析しました(図3)。得られた構造から、HfqにあるRNAとの結合部位のアミノ酸に、カタラーゼが結合し、Hfq-カタラーゼ複合体が安定化されるということが分かりました。また結合に関わるアミノ酸の数は多くなく、両者の結合力はそれほど強くないことが示唆されました。
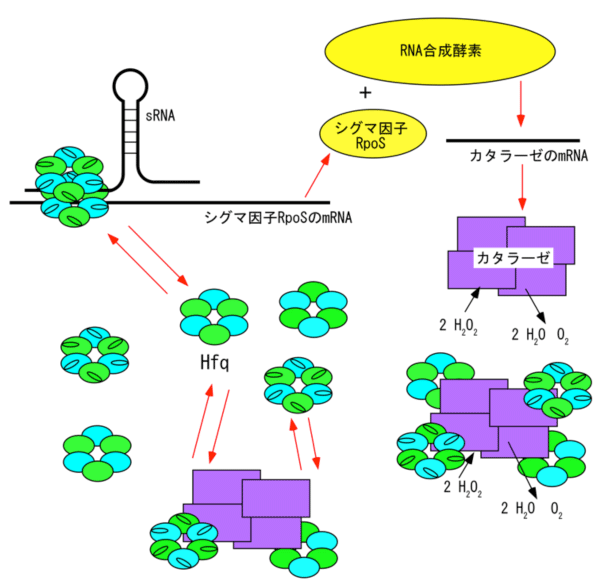
過酸化酸素が多量に生成されるストレス環境下では、カタラーゼの合成が促進されることが分かっています。今回の実験から多量のカタラーゼが細胞内に蓄積すると、Hfqとの複合体が形成されることが分かりました。これにより、HfqはRNAと結合ができなくなり、タンパク質の翻訳活性が抑制され、結果として、カタラーゼを含むストレス応答タンパク質の合成が抑制されます(図4)。一方、細胞分裂や細胞内の代謝作用で、合成されたタンパク質の濃度は時間の経過とともに下がっていきます。Hfqとカタラーゼの結合は強くなく、どちらかもしくは両方のタンパク質の量が減ると、Hfqはカタラーゼから外れるか、新しい複合体の形成が抑えられ、タンパク質の合成を調節するHfq本来の機能を発揮すると考えられます。
これらの結果は、Hfqの機能に関与する分子機構の一端を明らかにしただけでなく、ストレス応答タンパク質自身に、Hfqと複合体を形成することで自身の合成量を調節する機構があることを示しています。すなわち、生体内にはHfqの働きを制御し、ストレス応答タンパク質の合成量を調節することでストレスに対する防御反応のバランスを保つ機構があると言えます。
今後の期待
生物がさまざまな環境下で生きのびるには、ストレスに対する防御応答が非常に重要です。ストレス環境下で、Hfqが関与するタンパク質の翻訳調節は広範にわたりますが、その分子機構や他のタンパク質と結合した際の立体構造は明らかになっていませんでした。今回の成果により、Hfqとその仲間のタンパク質が関わる多くの生命活動への理解が深まるとともに、得られた立体構造の情報を基にしたタンパク質合成制御機構の生物工学への応用などが期待できます。
《参考図》
Hfqのリング状の構造を矢印で示す。左図横棒は、10ナノメートルに相当。
横棒は、100マイクロメートルに相当。
A: 結晶中での並び。紫色はカタラーゼ。水色はHfq。
B: Hfqとカタラーゼ複合体の拡大図。緑色と水色で示したHfqリングの1つが、紫色と黄色示したカタラーゼ1分子に結合する。他の分子モデルは灰色で示す。カタラーゼは4量体、Hfqは6量体のリング構造が機能単位。
ストレス環境下では、HfqとsRNAによりRNA合成酵素の補因子であるシグマ因子の1つRpoSの合成が促進される。RpoSはRNA合成酵素と複合体を形成し、DNA上でカタラーゼの遺伝子を認識し、そのmRNAが転写され、カタラーゼが合成される。細胞内に大量のカタラーゼが蓄積されると、Hfqとカタラーゼは複合体を形成し、これによりHfqの機能を阻害、RpoSの合成が抑制される。その結果、カタラーゼの増産が止まり、細胞内のカタラーゼ濃度はある一定の値以下に保たれる。
《用語解説》
[1] Hfq
リング状の構造を形成するRNA結合タンパク質。この仲間は細菌からヒトまで広く存在する。細菌では6量体のリングとなり、環境ストレス下で、小さなRNA分子「(sRNA)」と共にメッセンジャーRNA(mRNA)と相互作用し、mRNAの安定性と翻訳活性を調節する。これにより翻訳反応の制御、調節が行われる。ヒトでは7量体のリング構造を形成するLSmタンパク質として知られ、mRNAの編集などに関わる。この仲間は、いずれもRNAの構造を安定化させるRNAシャペロンとして働く。
[2] カタラーゼ
人から多くの好気性細菌まで広く分布する酵素。4量体を形成する。エネルギー代謝の際、細胞内に発生した有害な過酸化水素を速やかに酸素と水に分解する。
[3] 大型放射光施設SPring-8
理研が所有する、兵庫県の播磨科学公園都市にある世界最高の大型放射光施設。SPring-8の名前はSuper Photon ring-8 GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する、細く強力な電磁波のことである。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。タンパク質の結晶構造解析の分野でも、大きな成果を上げている。
[4] sRNA
タンパク質の配列情報を持たない短いRNA分子。多くの種類が発見されており、その機能も多岐にわたる。mRNAと相互作用し、タンパク質の翻訳調節も行う。
[5] RNA合成酵素
DNAの塩基配列を読み取って相補的なメッセンジャーRNA(mRNA)を合成する酵素。RNAポリメラーゼとも呼ばれる。
[6] シグマ因子
DNA上で転写を開始する場所を決定するタンパク質。RNAポリメラーゼと結合し、DNA上の特定の配列を認識することで、mRNAに転写する遺伝子を決定する。生物は、シグマ因子を複数持っており、環境に応じて細胞内での存在比率を変えることで、その環境に適した遺伝子群の転写を行う。大腸菌では、増殖定常期に様々なストレスに応答する中心的な制御因子としてシグマ因子RpoSが合成される。
|
《問い合わせ先》 独立行政法人理化学研究所 放射光科学研究推進室 (報道担当) (SPring-8に関すること) |
- 現在の記事
- ストレスに対する防御応答のバランスを保つ機構の一端を解明 −タンパク質合成を調節する「Hfq」の分子機構が明らかに−(プレスリリース)