ウイルス由来のRNA を感知し自然免疫受容体 Toll 様受容体7(TLR7)が活性化する機構を解明 ~TLR7 標的のアレルギー治療薬設計等に期待~(プレスリリース)
- 公開日
- 2016年10月12日
- BL41XU(構造生物学I)
平成28年10月12日
東京大学
大阪大学
科学技術振興機構(JST)
発表のポイント:
◆体内に侵入してきたウイルス由来のRNA を感知して自然免疫応答を引き起こすToll 様受容体7(TLR7)と呼ばれるタンパク質の立体構造を明らかにしました。
◆TLR7 が2 か所の部位でウイルス由来のRNA と低分子リガンド(注1)を同時に認識し、活性化される詳細な機構を明らかにしました。
◆TLR7 を標的としたワクチンアジュバント(注2)やウイルス感染やアレルギーの治療薬などの設計につながることが期待されます
東京大学大学院薬学系研究科の清水敏之教授、張志寛大学院生、大戸梅治准教授、東京大学医科学研究所の三宅健介教授、柴田琢磨助教、大阪大学大学院工学研究科の内山進准教授、首都大学東京理工学研究科の礒辺俊明教授、田岡万悟准教授らの研究グループは、微生物の侵入を感知して免疫系を活性化するTLR7 タンパク質の詳細な立体構造を世界で初めて明らかにしました。 発表雑誌 |
発表内容:
細菌やウイルスなどの病原体に対する防御機構として、自然免疫機構が備わっています。TLR 受容体は自然免疫系の受容体であり、病原体の持つ特定の分子の構造を認識しています。TLR 受容体が活性化すると、自然免疫が発動して炎症反応や抗ウイルス応答が起こり、病原体を排除します。TLR 受容体は膜貫通タンパク質であり、細胞外のロイシンというアミノ酸を多く持つ繰り返し配列部分で分子構造を認識し、細胞内のTIR ドメイン(注8)を通じてシグナルを伝えています。
TLR7 は一本鎖RNA の受容体として同定されており、HIV-1 やHCV ウイルス感染症に関与しています。また、自身の死細胞などから放出されるRNA へTLR7 が過度に応答する現象は、自己免疫疾患に関係するとされています。一方で、TLR7 はイミダゾキノリン誘導体(注9)やグアノシンなどの低分子化合物によって活性化されることも、報告されています。TLR7が活性化するとインターフェロンなどの産生を促し、免疫反応を引き起こします。このために、TLR7 はウイルス感染や自己免疫疾患に対する治療薬やワクチンのアジュバントなどのターゲットとして注目されています。しかし、TLR7 がどのようにこれらのリガンドを認識し、免疫を活性化するのかについて具体的な機構は不明でした。
本研究グループは、TLR7 による一本鎖RNA および低分子リガンドの認識機構を、TLR7-グアノシン-polyU、TLR7-loxoribine-polyU、TLR7-R848、の3 つの複合体の立体構造をX 線結晶解析(注10)で明らかにしました。
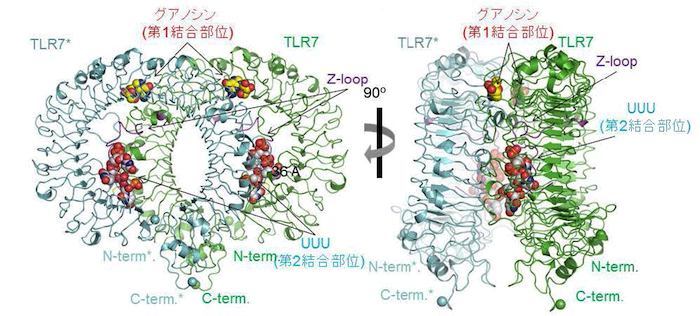
大型放射光施設SPring-8 の構造生物学Iビームライン(BL41XU)および高エネルギー加速器研究機構Photon Factory の強力なX線を使用して構造解析した結果、TLR7 はそれぞれのリガンドと2 : 2(または2 : 2 : 2)の複合体を形成することで活性化型のm 字型の2 量体構造をとることが明らかになりました(図1)。
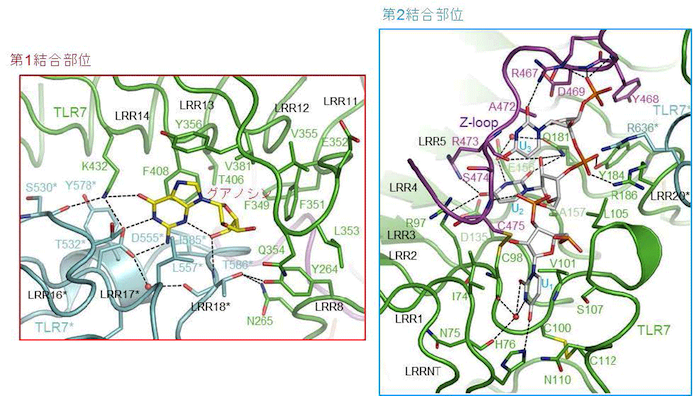
グアノシンなどの低分子リガンドは2 量体界面中の第1 結合部位に結合し特徴的な相互作用により認識されていました。また、19 のウリジンからなるpolyU の断片のUUU 部分はTLR7のN 末端側のLRR1-LRR5 の凹面およびZ-loop (LRR14 とLRR15 をつなぐ領域)から構成されている第2 結合部位に結合していました。UUU の中央のU 部分がその周辺のアミノ酸残基と塩基特異的およびリボース特異的な相互作用を形成していました(図2)。
さらに、TLR7 のリガンド特異性および活性化2 量体形成機構を調べました。TLR7 の第1結合部位は各種ヌクレオシドの中でグアノシンを特異的に認識すること、第2 結合部位は非末端部分にウリジン塩基を含む3 塩基以上の長さの一本鎖RNA を特異的に認識することを明らかにしました。また、一本鎖RNA によるTLR7 の活性化には、第1 結合部位と第2 結合部位の両方のリガンドが必須であること、さらにTLR7 の第1 結合部位のリガンドに対する親和性は、TLR7 が一本鎖RNA と結合することで強くなることが明らかになりました。
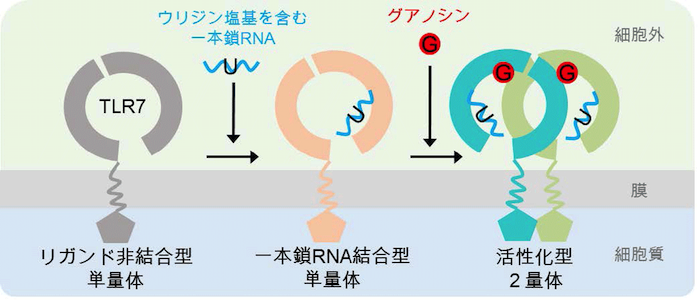
これらの結果から、TLR7 の活性化機構を提唱しました(図3)。TLR7 はまず第2 結合部位を用い、非末端部分にウリジン塩基を含む一本鎖RNA を認識します。次に、第1 結合部位にグアノシンが結合することによって、TLR7 が活性化します。一方で、R848 などの合成低分子リガンドの場合には、第1 結合部位への結合だけでTLR7 は活性化します。
エンドソーム(注11)に局在するTLR7 と、TLR7 に類似したTLR8 とTLR9 は一本鎖核酸を認識し、ウイルス感染や自己免疫疾患、さらにはがんまで、さまざまな疾患に関わっていることがわかっています。本研究グループによるこれまでのTLR8 およびTLR9 の結晶構造解析に加え、今回、さらに世界で初めてTLR7 の結晶構造解析に成功しました。
これまでTLR7 は一本鎖RNA を認識する受容体だと考えられていましたが、今回の結果から2つのリガンド結合部位を用いて2種類のリガンドを同時に認識し活性化することが明らかになりました。このことから、今後は2 つの作用点で制御するという新しい視点で、TLR7 をターゲットとした治療薬開発が進むと期待されます。
本研究は、戦略的創造研究推進事業(CREST)、科学研究費補助金、公益財団法人武田科学振興財団助成金、公益財団法人持田記念医学薬学振興財団助成金、公益財団法人第一三共生命科学研究振興財団助成金などの外部資金支援を受けて行われたものです。
【参考図】
2量体を構成している TLR7分子の一方(TLR7)を緑色、他方(TLR7*)を青色で示している。赤文字で示した第1結合部位, および青文字で示した第2結合部位の二箇所のリガンド結合部位が存在し、それぞれグアノシンおよびpolyUの一部のUUUが結合していた。
(左図) 第1結合部位の拡大図(グアノシンが結合している)。
(右図) 第2結合部位の拡大図(PolyUが結合している)。
グアノシン、polyU、TLR7、TLR7*およびZ-loopの炭素原子をそれぞれ黄色、灰色、緑色、シアンおよび紫色で示している 。水素結合を破線で示している。
グアノシンおよび一本鎖RNAによる TLR7の活性化モデル。まず第2結合部位で非末端ウリジン塩基を含む一本鎖RNAを認識し、次に第1結合部位でグアノシンを認識することで活性化型の2量体が形成される。
用語解説
注1) リガンド
特定の受容体に結合する物質で、それぞれのTLR(ヒトの場合TLR1~TLR10 が存在する)は微生物やウイルス由来の異なる物質をリガンドとする。
注2) アジュバント
抗原と混合して生体に投与することで、投与した抗原に対する免疫応答を増強する物質のことで抗原性補強剤とも呼ばれる。
注3) インターフェロン
細菌やウイルスなどの病原体の侵入に対して免疫系の細胞が分泌するタンパク質で、ウイルスの増殖を抑制する作用や免疫系を活性化するなどの作用を発揮する。
注4) polyU
多数のウリジンがホスホジエステル結合で結合した配列を持つRNA。本研究では19 のウリジンから構成されるRNA を使用している。
注5) グアノシン
RNA などの核酸の構成成分として使われている糖と塩基が結合した化合物(ヌクレオシド)
の一つ。生体中では他にアデノシン、チミジン、シチジン、ウリジンなどが使われている。
注6) loxoribine
TLR7 を活性化する低分子リガンドの1つでグアノシン誘導体である。
注7) R848
TLR7 を活性化する低分子リガンドの1つ、Resiquimod とも呼ばれる。TLR8 も活性化する。
注8) TIR ドメイン
TLR の細胞内の領域で、他のタンパク質と会合することでシグナルを伝達する役割を持っている。
注9) イミダゾキノリン誘導体
3環系のイミダゾキノリン骨格を有する有機化合物。
注10) X線結晶解析
物質の構造を解析する手法の一つ。調べたい物質の結晶に対してX線を照射して、そこから散乱されたX線の強度を観測し解析することで最終的に結晶の構造を知ることができる。
注11) エンドソーム
生体膜からできている小胞で細胞内に存在している。細胞内に取り込まれた物質の選別、分解、再利用などに関係する。
|
問い合わせ先 大阪大学大学院工学研究科 <JST事業に関すること> (SPring-8に関すること) |
- 現在の記事
- ウイルス由来のRNA を感知し自然免疫受容体 Toll 様受容体7(TLR7)が活性化する機構を解明 ~TLR7 標的のアレルギー治療薬設計等に期待~(プレスリリース)
 mol.f.u-tokyo.ac.jp
mol.f.u-tokyo.ac.jp