病原菌における抗菌ガス分解酵素の新機能 -キノール依存型NORは ATP合成につながる膜電位を形成する-(プレスリリース)
- 公開日
- 2018年02月27日
- BL41XU(構造生物学I)
2017年2月27日
理化学研究所
兵庫県立大学
理化学研究所(理研)放射光科学総合研究センター城生体金属科学研究室のデヴィッド・ヤング国際プログラム・アソシエイト(研究当時)、城宜嗣主任研究員(研究当時、現兵庫県立大学大学院生命理学研究科教授)、當舎武彦専任研究員(研究当時)らの国際共同研究グループ※は、髄膜炎菌[1]が持つ抗菌ガスの一酸化窒素(NO)[2]の分解酵素がNOを分解するに伴い、生命エネルギーのアデノシン三リン酸(ATP)[3]の合成につながる膜電位[4]の形成を引き起こすことを発見しました。 論文情報 |
注1)J. Reimann, U. Flock, H. Lepp, A. Honigmann, P. Ädelroth “A pathway for protons in nitric oxide reductase from Paracoccus denitrificans.” Biochim Biophys Acta. 2007, 1767, :362-73
※国際共同研究グループ
| 理化学研究所 放射光科学総合研究センター 城生体金属科学研究室(研究当時) | ||
| 国際プログラム・アソシエイト(研究当時) | デヴィッド・ヤング(David Young) | |
| 主任研究員(研究当時) | 城 宜嗣 | (しろ よしつぐ) |
| (現 兵庫県立大学大学院生命理学研究科 教授) | ||
| 専任研究員(研究当時) | 當舎 武彦 | (とうしゃ たけひこ) |
| (現 放射光科学総合研究センター 利用システム開発研究部門 | ||
| ビームライン基盤研究部 生命系放射光利用システム開発ユニット 専任研究員) | ||
| 兵庫県立大学大学院 生命理学研究科 | ||
| 准教授 | 村本 和優 | (むらもと かずまさ) |
| ストックホルム大学 | ||
| 大学院生 | ナタリー・ゴンスカ(Nathalie Gonska) | |
| 准教授 | ピア・アデルロス(Pia Ädelroth) | |
| リバプール大学 | ||
| 教授 | サマー・ハスナイン(S. Samar Hasnain) | |
背景
病原菌がヒトの体内に侵入すると免疫系が機能し、病原菌に攻撃をしかけます。その第一段階として、食細胞であるマクロファージ[9]が病原菌を内部に取り込み、一酸化窒素(NO)合成酵素の働きにより抗菌ガスのNOが産生されます。これに対し、病原菌は一酸化窒素還元酵素(NOR)によりNOを還元・無毒化します。また、NORは酸素分子(O2)を使う呼吸において、O2を還元するシトクロム酸化酵素の先祖だと考えられており、生命の進化とも関連の深い酵素タンパク質です。
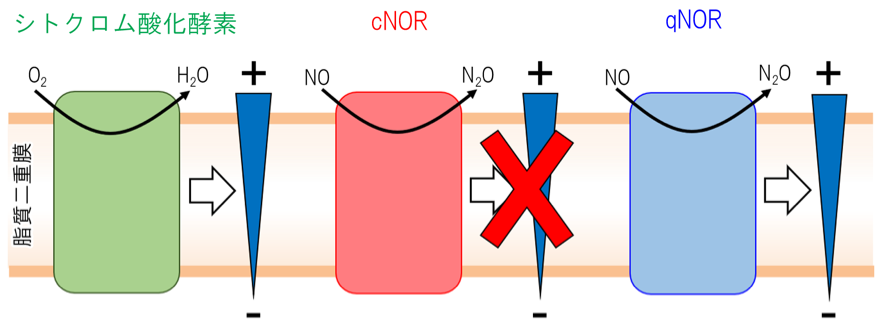
NORにはNOの還元に用いる電子供与体の違いから、シトクロムc依存型のcNORとキノール依存型のqNORの2種類が存在します。これまで、NORに関する研究はcNORについて盛んに行われてきました。その結果、シトクロム酸化酵素はO2の還元に必要となるプロトン(水素イオン)を生体膜の内側から取り込むことで、膜電位を形成しアデノシン三リン酸(ATP)の合成を促すのに対し(図1左)、cNORはNO還元に必要なプロトンを細胞膜の外側から取り込むため、膜電位を形成しないことが示されています(図1中)。
一方、城主任研究員(研究当時)らは、これまでに明らかにした好熱菌[10]由来qNORの構造解析から、qNORはcNORと異なり、NO還元に伴った膜電位の形成を引き起す可能性を提案しました注2)。しかし、好熱菌由来qNORは酵素活性が低いため、十分な機能解析を行うことができませんでした。
そこで国際共同研究グループは、髄膜炎菌において、qNORを欠損すると髄膜炎菌がヒト細胞内で生きられなくなることに注目しました。これは、髄膜炎菌由来qNORが高いNO分解活性を持つことを示しており、qNORを用いれば、機能解析を進められると考えました。
シトクロム酸化酵素は、酸素分子(O2)の還元を触媒するのに伴い膜電位を形成する。しかし、シトクロム酸化酵素の祖先であるシトクロムc依存型一酸化窒素還元酵素(cNOR)は、NO還元反応に伴う膜電位の形成を行わない。本研究では、キノール依存型一酸化窒素還元酵素(qNOR)についての機能を調べたところ、qNORはシトクロム酸化酵素同様、NO還元反応に伴い膜電位を形成することが分かった。
注2)2012年1月23日プレスリリース「プロトンの通り道から呼吸酵素の起源にせまる」
研究手法と成果
国際共同研究グループはまず、大腸菌を用いて髄膜炎菌由来qNORを発現する発現系を構築し、qNORを高い酵素活性を保持した状態で精製する方法を確立しました。精製したqNORを人工脂質二重膜(リポソーム)に組み込み、酵素活性を測定したところ、qNORはNOを還元するとともに、膜電位を形成する機能を持つことが分かりました(図1右)。比較のために、cNORでも同じ測定をしましたが、過去の報告のとおり、NOの還元によって膜電位が形成されることはありませんでした。
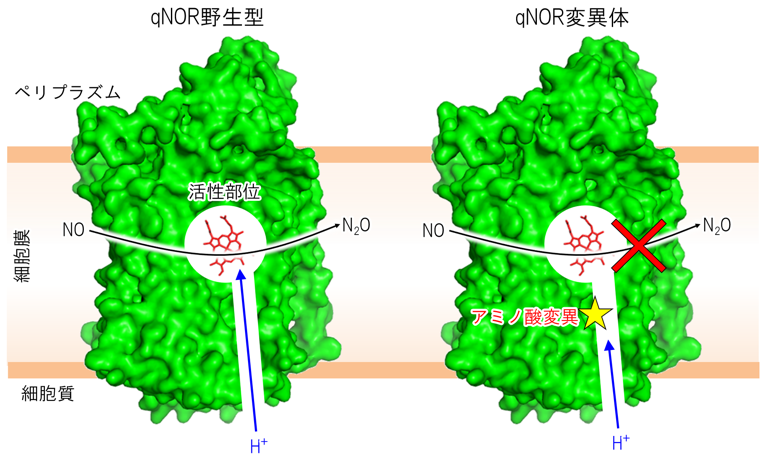
さらに、さまざまな種類の界面活性剤で可溶化したqNORを用いて結晶化条件を検討し、単結晶が得られる条件を見つけ出しました。大型放射光施設「SPring-8」のBL41XUにおいて、得られた結晶に高輝度X線を照射し、測定したデータを解析したところ、qNORの構造を4.5 オングストローム(Å、1Åは100億分の1メートル)の分解能で決定できました。得られた構造から膜電位の形成と関連が深いプロトンの輸送経路を推測し、経路に位置するアミノ酸の変異体を作製しました。その結果、qNORのタンパク質内部にある活性部位と細胞質側の間にあるアミノ酸残基を別のアミノ酸に変異させると、酵素活性の大きな低下がみられました(図2右)。一方、cNORの対応する位置に存在するアミノ酸に変異を加えても、酵素機能への影響がほとんどないことが報告されています。
以上の結果から、qNORはcNORと異なり、細胞質側からのプロトンを利用してNOの分解反応を行うことで、細胞膜内側の正電荷を減少させ、膜電位を形成することが示されました(図2左)。この結果は、NORがどのようにして膜電位の形成といった機能を獲得したのか知るための手がかりとなるものであり、NORからシトクロム酸化酵素への分子進化の過程を理解する糸口になるといえます。
左) 髄膜炎菌由来qNORの構造解析から、NO還元に必要となるプロトン(H+)は細胞質側から活性部位へと伝達されることが示された。
右) プロトン輸送経路に位置するアミノ酸に変異を加えたところ、NO還元活性に大きな低下がみられたことから、NO還元に必要なプロトンは、細胞質側から取り込まれることが示された。
今後の期待
本研究では、qNORがシトクロム酸化酵素と同様に、触媒作用に伴い膜電位を形成することが示されました。今後、qNORの構造と機能の関連についての研究が進むことで、呼吸酵素がどのように分子進化したのか理解が進むと期待できます。その過程で得られる知見は、人工的に酵素機能を設計するための指針にもなります。
また、qNORは、病原菌の生存戦略に利用される酵素タンパク質であるため、その阻害剤は、抗菌薬として機能すると期待できます。qNORはヒトには存在しない酵素なので、qNORに特異的な阻害剤が開発できれば、副作用の少ない抗菌薬となる可能性があります。本成果は、qNORの阻害剤の設計指針も与えてくれます。
補足説明
[1] 髄膜炎菌
髄膜炎の起炎菌。アフリカには、髄膜炎ベルトと呼ばれる流行地帯がある。
[2] 一酸化窒素(NO)
ラジカルを持つガス状の二原子分子。反応性が高いため、生体内ではシグナル伝達物質として利用されている。また、タンパク質、核酸や脂質と反応することで細胞損傷を引き起こす点を利用し、生体内では抗菌ガスとしても用いられる。
[3] アデノシン三リン酸(ATP)
アデノシンに三つのリン酸基が結合したもので、加水分解により得られるエネルギーが生命活動に利用されている。全ての真核生物がATPを利用していることから、生体のエネルギー通貨と呼ばれている。
[4] 膜電位
生体膜を隔てた電位差。生体膜の内側と外側で、イオンの組成や濃度が異なるために生じる。生じた膜電位は、さまざまな膜タンパク質を機能させるために必要である。
[5] 一酸化窒素還元酵素(NOR)、cNOR、qNOR
細胞膜に存在し、一酸化窒素(NO)を還元し、亜酸化窒素(N2O)へと無毒化する呼吸酵素(2NO + 2H+ + 2e- → N2O + H2O)。髄膜炎菌などいくつかの病原菌は、この酵素を利用することで、免疫系が産生するNOを無毒化している。アミノ酸配列および電子供与体の違いから2種類に大別され、細胞外の電子伝達蛋白質であるシトクロムcを電子供与体とするものをcNOR、細胞膜中に存在するキノール(quinol)を電子供与体とするものをqNORと呼ぶ。
[6] シトクロム酸化酵素
酸素分子(O2)を用いた呼吸の根幹を担う酵素。ミトコンドリア内膜や細菌の細胞膜に存在し、O2を還元し、水分子を生成する(O2 + 4H+ + 4e- → 2H2O)。酸素の還元反応に伴い、生体膜の内側からプロトンを取り込み一部外側へと輸送することで、膜電位を形成する。
[7] 大型放射光施設「SPring-8」
理化学研究所が所有する兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。その運転管理と利用者支援は高輝度光科学研究センターが行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。今回、X線回折実験利用したBL41XUでは、実験室レベルでのX線発生装置では構造解析が不可能な微小結晶であっても、高分解能でのデータ取得が可能。
[8] X線結晶構造解析
タンパク質の結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、タンパク質を構成する原子の立体的な配置を調べる方法。この方法によって、タンパク質の立体構造や内部構造を知ることができる。
[9] マクロファージ
体内に侵入した異物を取り込み消化すること(食作用)を主な役割とする免疫細胞。マクロファージや顆粒球などの食細胞は、まとめてミエロイド系細胞とも呼ばれる。
[10] 好熱菌
至適生育温度が45℃以上の微生物の総称。温泉や熱水域、熱水噴出孔などに存在する。
発表者・機関窓口 兵庫県立大学大学院 生命理学研究科 <機関窓口> 兵庫県立大学播磨理学キャンパス (SPring-8 / SACLAに関すること) |
- 現在の記事
- 病原菌における抗菌ガス分解酵素の新機能 -キノール依存型NORは ATP合成につながる膜電位を形成する-(プレスリリース)
 spring8.or.jp(當舎)
spring8.or.jp(當舎)