プロトンの通り道から呼吸酵素の起源にせまる 一立体構造比較から呼吸酵素の分子進化を推測可能に-(プレスリリース)
- 公開日
- 2012年01月23日
- BL41XU(構造生物学I)
- BL44B2(理研 物質科学)
2012年1月23日
独立行政法人理化学研究所
本研究成果のポイント
●嫌気呼吸に関わる一酸化窒素還元酵素の一種「qNOR」の立体構造を新たに解明
●嫌気呼吸酵素には、好気呼吸酵素が持つプロトンポンプの原型にあたる構造が存在
●分子進化を模倣した人工分子の設計指針の可能性
|
独立行政法人理化学研究所(野依良治理事長)は、嫌気呼吸を行う好熱性細菌が持つ一酸化窒素還元酵素(qNOR) *1の立体構造解析を行い、好気呼吸酵素に備わっているプロトンポンプ*2の原型にあたる構造を発見しました。この発見は、呼吸酵素が数十億年かけて培ってきた分子進化の道筋の一端を突き止めたことになります。これは、理研放射光科学総合研究センター(石川哲也センター長)城生体金属科学研究室の城宜嗣主任研究員と、基幹研究所(玉尾皓平所長)杉田理論生物化学研究室の杉田有治准主任研究員らを中心とした研究グループの成果です。 (論文) |
1.背景
一酸化窒素還元酵素(NOR)は、一酸化窒素(NO)を還元し、亜酸化窒素(N2O)を生成します。脱窒*7を行う微生物(脱窒菌)の細胞膜上に存在し、脱窒の途中で産生される細胞毒性が高いNOを速やかに分解します。NORは、生物が生きていくために必須の生理現象である「呼吸」の進化と深い関連があるため、研究者の注目を集めています。地球誕生後に現れた微生物は、窒素や硫黄の化合物を利用した嫌気呼吸を用いました。しかし、約30億年前に植物の祖先が光合成により水分子から酸素分子(O2)を作り始めたことで、生物の呼吸の様相は劇的に変わりました。生物はエネルギーの高いO2を積極的に呼吸に利用する好気呼吸生物と、O2がもつ細胞毒性から逃れた環境で生きる嫌気呼吸生物に分かれたのです。
好気呼吸では、シトクロム酸化酵素(COX)が好気呼吸酵素としてプロトンを利用してO2の還元反応を触媒し、それにより得られるエネルギーを利用して細胞の内側から外側へプロトンを汲み出すプロトンポンプとして機能します。そして細胞膜内外に生じるプロトン濃度勾配によって、生体エネルギーであるアデノシン三リン酸(ATP)の合成酵素を機能させます。一方、嫌気呼吸ではNORがCOXと同様に働き、プロトンを利用してNOを還元しN2Oを生成します。ただし、COXとは異なり、NORにはプロトンポンプ機能はなく、全てのNORは細胞の外側からのプロトンを利用してNO還元を行うと考えられていました。実際、2010年に研究グループが報告した嫌気呼吸を行う緑膿菌の一酸化窒素還元酵素(cNOR)*1の構造には、プロトンを細胞内から外へ汲みだす通り道は存在せず、それまでの定説を支持する結果でした(2010年11月26日プレスリリース)。
では、COXはNORから進化する過程で、どのようにプロトンポンプ機能を獲得したのでしょうか?この疑問を解くために、研究グループは、緑膿菌のcNORとはタイプが異なるqNORの立体構造を詳細に調べることに挑みました。
2.研究手法と成果
NORは、細胞膜上に存在する膜タンパク質です。一般的に、このような膜タンパク質は、溶液中で凝集を起こしやすく構造解析に適した良質な結晶を得ることが困難です。研究グループは、qNORの結晶を得るために、高温下で生育し、熱安定性が高く扱いが容易な好熱性細菌(Geobacillus stearothermophilus)がもつqNORに注目し、さまざまな精製条件や結晶化条件を検討しました。その結果、良質な結晶を得ることに成功しました。微小結晶でも高い分解能で解析できるSPring-8を用いてX線結晶構造解析を行い、qNORの立体構造を2.5 Åの分解能で決定することができました。
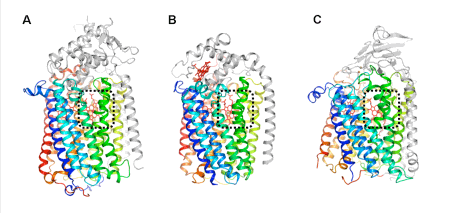
構造解析の結果、qNORの全体構造は、研究グループが2010年に明らかにした緑膿菌のcNORや好気呼吸酵素であるCOXと類似していました(図1)。qNORの活性部位も、cNORとよく似ており、ヘム*8と金属原子から構成され、その近くには酵素機能に必須である2つのグルタミン酸が存在していました。ところが、NO還元反応に必要なプロトンの通り道を見比べると、cNORとqNORの間に大きな違いが見られました。cNORでは、細胞の外側から活性部位へとつながるプロトンの通り道が存在していましたが、qNORには、対応する位置にプロトンの通り道が見られませんでした。その代わりにqNORでは、新たに細胞の内側から活性部位へと続くプロトンの通り道を発見しました。この発見したプロトンの通り道の役割を検討するために、アミノ酸置換体を利用した実験や理論化学に基づいた分子動力学計算*9を行った結果、プロトンを細胞の内側から活性部位へ導きNO還元反応に使われていることが分かりました。この発見は、「すべてのNORは細胞の外側からのプロトンを利用してNO還元を行う」というこれまでの定説を覆します。
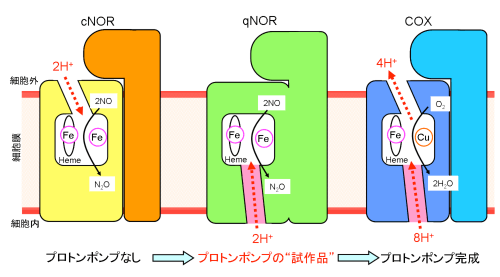
また、大変興味深いことにqNORに存在するプロトンの通り道は、COXのプロトンポンプの一部と類似する位置に存在していました。具体的には、COXのプロトンポンプは、細胞の内側から活性部位を経由して外側へという道筋になっていますが、qNORのプロトンの通り道は、COXのプロトンポンプ経路のうち、細胞の内側から活性部位へとつながる部分と一致していました(図2桃色部分)。
以上の結果から、qNORには、COXにおけるプロトンポンプの原型ともいえる"試作品"が存在していることが明らかとなり、COXの始原型酵素であると推測することができます。
3.今後の期待
今回qNORの立体構造を解明したことで、遺伝子配列の解析から進化的に関連がある2種類の嫌気呼吸酵素(cNORとqNOR)、およびさまざまな種類の好気呼吸酵素(COX)の構造が勢ぞろいしました。これまでは、遺伝情報に基づくアミノ酸の配列比較から呼吸酵素の分子進化に関する予測をしていましたが、個々の呼吸酵素の立体構造の比較が可能になり、生物が長年かけて培ってきた分子進化の戦略をより詳しく理解することができます。特に、呼吸酵素の分子進化におけるブレークスルーとなったプロトンポンプ機能の獲得について大きな手がかりを得ることができました。
今後は、今までに得られた知見と理論計算による予測を組み合わせて、NORにプロトンポンプ機能を付与するなど人工的な機能変換や、還元反応中のNORの立体構造解析にも挑戦し、呼吸酵素の分子進化、特にNO還元からO2還元への機能変換の過程について、新たな知見が得られるものと期待できます。また、このような知見は、呼吸酵素の分子進化についての理解を深めるだけでなく、タンパク質の高機能を模倣するような人工分子の設計指針にもなりうると期待できます。
《参考資料》
(A) qNOR、(B)cNOR、(C) COXの全体構造。酵素の中心となる部位は(カラーで示している)、全ての呼吸酵素でよく似た構造をしている。また、酵素反応が行われる活性部位(黒色の点線で囲った部位)には、活性や電子伝達に関わるヘム分子(赤色のスティック)が存在する。
cNORとqNORにおけるNO還元反応に必要なプロトンの通り道、およびCOXにおけるプロトンポンプ経路の模式図。プロトンの運ばれる方向を赤色の矢印で示した。定説通り、cNORでは、NO還元反応に必要なプロトンが細胞外から活性部位へと運ばれる通り道がみられた。一方で、qNORには、細胞外からのプロトンの通り道はなく、細胞内と活性部位をつなぐプロトンの通り道を発見した。COXのプロトンポンプ経路は、細胞内から活性部位のヘムを経由して細胞外へと続く。今回発見したqNORのプロトンの通り道(図中の桃色の部位)は、COXのプロトンポンプの一部である桃色で示した細胞内と活性部位をつなぐ位置に類似していることが分かる。
《補足説明》
*1 一酸化窒素還元酵素(NOR、qNOR、cNOR)
一酸化窒素(NO)を還元し、亜酸化窒素(N2O)を生成する(2NO + 2H+ + 2e− → N2O + H2O)呼吸酵素。アミノ酸配列および電子供与体の違いから2種類に大別され、細胞膜中に存在するキノール(quinol)を電子供与体とするものをqNOR、細胞外の電子伝達蛋白質であるシトクロムcを電子供与体とするものをcNORと呼ぶ。
*2 プロトンポンプ
生体内で、光エネルギーや化学反応を利用して、細胞膜を隔てたプロトンの能動輸送を行い、細胞膜の内外にプロトン濃度勾配を形成する反応系。プロトン濃度勾配は生体エネルギーであるATPを作り出すために必要。
*3 アデノシン三リン酸(ATP)
地球上の生物が共通して用いるエネルギーの源。エネルギーを必要とする生体内での反応には、必ず使用される。
*4 シトクロム酸化酵素(COX)
酸素呼吸において最も重要な酵素。電子と水素イオンを利用して、酸素分子の還元(O2 + 4H+ + 4e− → 2H2O)を行う。この反応に伴って、ATP合成に必要な駆動力を生み出す。
*5 プロトン(H+)
水素イオンのこと。水素原子が電子(e−)1個を失った一価の陽イオン。電子とともに、酸化還元を伴うさまざまな化学反応に関与。
*6 大型放射光施設SPring-8
兵庫県佐用郡佐用町に位置する世界最大級の放射光施設で、強力なX線を利用できる。今回、X線回折実験に利用したBL41XUやBL44B2(現在は、高エネルギー粉末回折法を利用した物質科学ビームライン)では、実験室レベルでのX線発生装置において、構造解析が不可能な微小結晶についても、高い分解能でのデータの取得が可能。
*7 脱窒
地表に取り込まれた窒素酸化物を再び大気に放出する過程のこと。主に土壌細菌などによって行われ、地球上での窒素原子の循環を維持する上で重要な役割を担っている。別名、硝酸塩呼吸とも呼ばれる嫌気呼吸の一種。
*8 ヘム
有機化合物であるポルフィリン分子の中心に鉄原子が配位した錯体分子。ヘモグロビンやシトクロムなどタンパク質の補欠分子族として用いられ、酸素分子などの気体分子の結合、電子伝達、化学反応の触媒として機能する。
*9 分子動力学計算
分子構造の動的構造変化を説明するための理論化学に基づいた手法。
|
《問い合わせ先》 播磨研究所 研究推進部 企画課 (報道担当) (SPring-8に関すること) |
- 現在の記事
- プロトンの通り道から呼吸酵素の起源にせまる 一立体構造比較から呼吸酵素の分子進化を推測可能に-(プレスリリース)