脂肪酸代謝システムの鍵となるタンパク質の構造を解明(トピック)
- 公開日
- 2004年07月13日
- BL26B1(理研 構造ゲノムI)
- BL41XU(構造生物学I)
- BL45XU(理研 構造生物学I)
平成16年7月13日
独立行政法人理化学研究所
|
独立行政法人理化学研究所(野依良治理事長)は、大型放射光施設(SPring-8)の理研ビームラインBL26B1、BL41XU、BL45XUを使用し、生物の長鎖脂肪酸代謝システムの鍵となるタンパク質である、長鎖脂肪酸アシル化補酵素A合成酵素(LC-FACS)が働く際の動的な立体構造変化を明らかにし、長鎖脂肪酸が長鎖脂肪酸アシル化補酵素A※1に変換される迄の順序だった二段階触媒反応の過程を構造に基づいて詳細に記述する事を可能にしました。またこの触媒反応の中で、今までは実験的に検出する事ができなかった長鎖脂肪酸アシル化AMP※2がいったん反応中間体として形成されることを、世界で初めて実験的に観測することに成功しました。理研播磨研究所・宮野構造生物物理研究室の宮野雅司主任研究員、吾郷日出夫先任研究員、久永裕子ジュニアリサーチアソシエイトらによる研究成果です。 (論文) |
1.背 景
長い炭素の鎖を持つ長鎖脂肪酸は、その内部に高いエネルギーを蓄えた物質で、生物はβ酸化※3と言う方法で脂肪酸に蓄えられたエネルギーをATP※4に変換してから利用しています。長鎖脂肪酸からβ酸化によってエネルギーを取り出す為には、長鎖脂肪酸はいったん長鎖脂肪酸アシル化補酵素Aと言う物質に作り替えられる事が必要で、この化学反応を触媒する酵素がLC-FACSです。高等生物は、LC-FACSによって合成される長鎖脂肪酸アシル化補酵素Aを、生体の働きを調節する為の脂質性情報伝達物質としても利用しているため、LC-FACSは肥満やアポトーシスなどの多くの生体制御に関わっていると考えられています。また細菌の中には、栄養源となる脂質を、細胞内に取り込む際にLC-FACSを利用している細菌がいる事もわかっています。このようにLC-FACSは、エネルギー生産や細胞機能の調節などの生体にとっての基本的な働きにおいて重要な役割を担っている酵素であるため、LC-FACSの研究には長い歴史があります。1970年代頃には既にLC-FACSの二段階触媒反応すなわち、始めに長鎖脂肪酸がATPと反応して長鎖脂肪酸アシル化AMP と言う物質に作り替えられ、次に長鎖脂肪酸アシル化AMPが補酵素Aと反応し、最終的に長鎖脂肪酸アシル化補酵素Aが作られるという過程が、提唱され広く受け入れられる様になりました。しかし、この二段階触媒反応の過程で必ず存在するはずの長鎖脂肪酸アシル化AMPと言う反応中間体は、いっさい実験的にとらえる事ができないまま、今日に至っています。また外部から反応液に加えられた長鎖脂肪酸アシル化AMPをLC-FACSは利用できない事も生化学的に知られていましたが、その理由も未解明のまま残されていました。今回の研究は、原子分解能のLC-FACSの立体構造を決定する事で、提唱されているLC-FACSの二段階触媒反応を立体構造に基づいて解釈し、さらにこれら未解明の問題を明らかにする為に行われました。
2.研究手法と成果
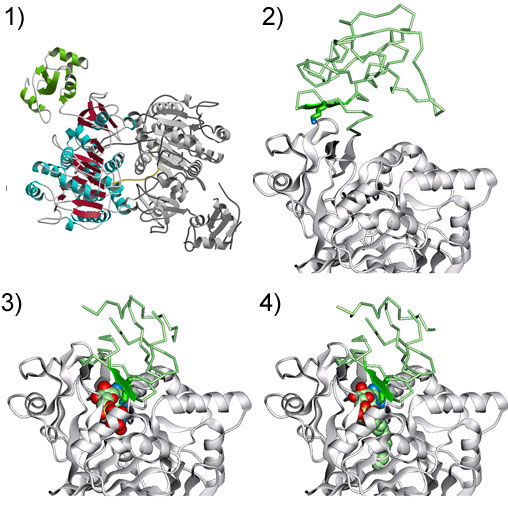
LC-FACSの酵素触媒反応のそれぞれの段階に対応するLC-FACSの原子構造を明らかにする為には、酵素反応の各々の段階に相当する構造を持つLC-FACSの結晶を作る必要がありました。実験に使用するLC-FACSは、高度好熱菌Thermus thermophilus HB8株由来のLC-FACSを大腸菌を使って発現し、さらに大腸菌由来の脂質成分を含まないLC-FACSを得る為の精製法を確立し、結晶化に使用しました。X線結晶構造解析したLC-FACSは、1)ATPや補酵素A※1を含まないLC-FACSの結晶(アポ結晶)(図1-1、図1-2)、2)ATP類似体であるAMP-PNP※5と結合したLC-FACSの結晶(AMP-PNP複合体結晶)(図1-3)、3)ミリストイルAMP※6と結合したLC-FACSの結晶(myristoyl-AMP複合体結晶)(図1-4)の三種類で、アポ結晶は酵素反応が始まる前の状態、AMP-PNP結晶は酵素反応を開始する為の準備が整い、脂肪酸を受け入れる直前の状態、myristoyl-AMP結晶は、LC-FACSの触媒作用によって長鎖脂肪酸アシル化AMPが作られた状態にそれぞれ対応しています。これらの構造解析の結果からLC-FACSの二段階触媒反応について次のような新しい知見を得る事ができました。
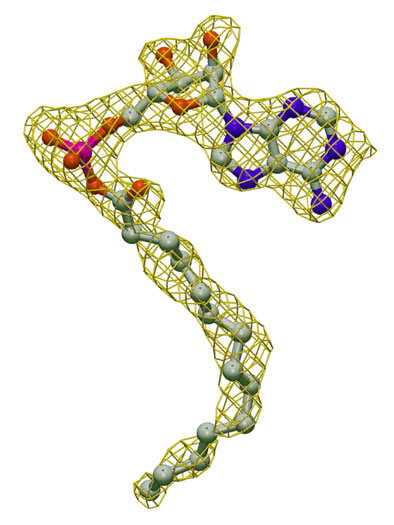
- a)LC-FACSの触媒反応過程で、長鎖脂肪酸アシル化補酵素Aが存在する事を世界で初めて実験的に観測しました(図2)。AMP-PNP複合体結晶を、長鎖脂肪酸であるミリスチン酸を含む溶液に浸し、結晶中で触媒反応を進めることで作成したmyristoyl-AMP複合体結晶の中では、ミリスチン酸とAMP-PNPはアシル結合したミリストイルAMPとして見いだされました。
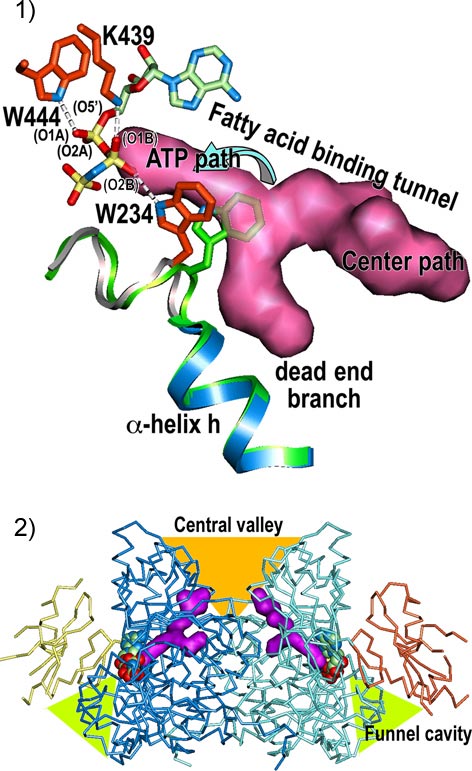
b)一連の触媒反応の為の構造的環境は、ATPの結合によってLC-FACSの構造が変化する事で準備される事がわかりました。LC-FACSは大小二つのドメイン※7が短いペプチド鎖で連結された構造をしていました。ATPと結合していないアポ結晶中のLC-FACSでは、二つのドメインの間には広い空間があり、いわば開いた構造をとっているのに対し(図1-2)、AMP-PNP複合体結晶とmyristoyl-AMP複合体結晶の中では、どちらも小さなドメインが大きなドメインの上に覆いかぶさった閉じた構造をしていました(図1-3、図1-4)。また長鎖脂肪酸の長い炭素鎖を受け入れる為の構造もATPの結合によって形成される事がわかりました。ATPと結合していないアポ結晶中のLC-FACSでは、トリプトファンと呼ばれるアミノ酸の側鎖によって閉じられていますが、ATPが結合したLC-FACSでは、トリプトファンの側鎖が移動し、大きなドメインの中にトンネルが貫通しています(図3-1、図3-2)。
c)脂肪酸は脂肪酸を受け入れるトンネルのなかを一方通行で動いていく事がわかりました。脂肪酸を受け入れるトンネルは大きなドメインを貫通していますが(図3-2)、片方の入り口はATPと小さなドメインで覆われている為、脂肪酸は反対側の入り口から入っていかざるを得ません。この脂肪酸を一方向に動かしながら触媒反応を進める仕組みは、水にほとんど溶けない長鎖脂肪酸を細胞膜などの供給源から取り込み、酵素反応の結果できた水に溶けやすい長鎖脂肪酸アシル化補酵素Aを効率よく細胞内に流し込んでいく為には大変都合の良い仕組みです。
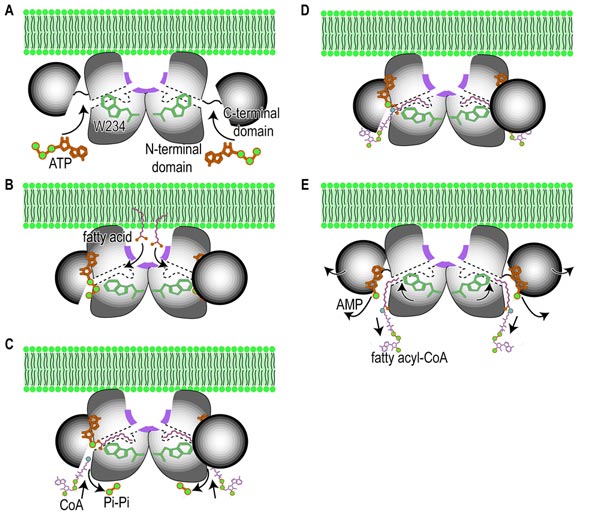
これらの知見を総合することで、LC-FACSの酵素反応では始めに、A)小さなドメインが閉じた構造をとる事によるATPの結合と、脂肪酸結合トンネルの開通が起こり、引き続き順番にB)脂肪酸の取り込み、C)長鎖脂肪酸アシル化AMPの合成とピロリン酸の脱離、引き続く補酵素Aの結合、D)長鎖脂肪酸アシル化補酵素Aの合成とすすみ、E)小さなドメインが開いた構造に戻り、AMPと長鎖脂肪酸アシル化補酵素Aが脱離することで完了する触媒の分子機構を描く事が可能になりました(図4)。
3.今後の展開
LC-FACSはβ酸化による生体エネルギー物質ATP の生産や、脂質性情報伝達物質を介した細胞の働きの調節において重要な役割を担っている酵素です。また細菌のLC-FACSは、細菌が成長する為に必要な栄養素としての脂肪酸を、細胞外から取り込む際にも働く事が知られています。LC-FACSは脂肪酸とATP、さらに補酵素Aの三つの分子の化学反応を順序よく触媒し、長鎖脂肪酸アシル化補酵素Aを合成する事でこれらの役割を担っています。そのためLC-FACSの触媒機構を原子レベルで解明することは、エネルギー生産や細胞機能の調節などの生体の基本的な働きを知る基礎科学だけでなく、抗菌剤の開発などの応用にも寄与することが期待されます。
<参考資料>
1)LC-FACSは二分子が集まって二量体構造を形成していた。一つの分子は灰色で示し、残りの分子の小さいドメインを緑、大きなドメインを赤と水色で着色した。
2)アポ結晶中の何も結合していないLC-FACSの構造。小さいドメインを緑で表し、大きなドメインを灰色でぬり分けた。
3)AMP-PNPを結合したLC-FACSの構造。結合したAMP-PNPはそれぞれの原子を球体で示した。
4)ミリストイルAMPを結合したLC-FACSの構造。二つのドメインの相対的な位置関係は3)と4)で基本的に同じである。
黄色のかごで結晶中で観測された電子密度を表している。
大きなドメインを貫通する脂肪酸結合トンネルを赤紫色で示した。1)AMP-PNPを結合していない状態ではトリプトファン残基(W234)の側鎖(緑)が脂質結合トンネルの中に突き出して、トンネルを塞いでいる。一方AMP-PNPを結合すると、トリプトファン残基の側鎖(赤)は脇にずれてトンネルが貫通する。
2)大きなドメイン(青、水色)を脂肪酸結合トンネルが貫通しているが、一方の出口は結合したAMP-PNPと小さなドメイン(橙色と薄黄色)で塞がれているため、脂肪酸の取り込みはCentral valley側からに限られる。
A)LC-FACSの小さなドメインはATPが結合するまで固定されていない。また、長鎖脂肪酸結合トンネルはトリプトファン残基の側鎖によって閉じられているので反応が開始するまで長鎖脂肪酸が結合できない。B)LC-FACSはATPが結合すると、小さなドメインが閉じた構造をとり酵素反応を行う場を形成すると同時に、トリプトファン残基の側鎖が脂質結合トンネルからずれ、長鎖脂肪酸が結合できるようになる。C)2段階反応の中間生成物である長鎖脂肪酸アシル化AMPが形成されるとATPから分解されたピロリン酸が離れ、次に補酵素Aが結合する。D)AMPと補酵素Aが交換反応をして最終生成物である長鎖脂肪酸アシル化補酵素Aが合成される。E)LC-FACSはすべての反応が終わると、順次精製産物を離していく。
<用語解説>
- ※1 長鎖脂肪酸アシル化補酵素A
炭素が12から22個程度連なった鎖を持つ長鎖脂肪酸と呼ぶ。補酵素Aはチオール基を持つ低分子で様々なアシル基転移反応で使われる。長鎖脂肪酸アシル化補酵素Aは補酵素Aのチオール基と長鎖脂肪酸のカルボキシル基がチオエステル結合した物質で水溶性が高く、ほとんど水に溶けない長鎖脂肪酸より、基本的に水系の細胞内化学反応の材料として適している。
- ※2 長鎖脂肪酸アシル化AMP
長鎖脂肪酸にアデノシン一リン酸(AMP)がアシル結合した物質。
- ※3 β酸化
脂肪酸アシル化補酵素Aの中の炭素を二つずつ切断し、アセチル補酵素Aを生産する。炭素数16個のパルミチン酸のβ酸化で生産されたアセチル補酵素Aがすべてクエン酸回路に取り込まれるとエネルギー物質ATPが130個作られる。
- ※4 ATP
アデノシン三リン酸。アデノシンにリン酸が三つ高エネルギー結合した物質で、生物はそのリン酸を切断する事でそのエネルギーを利用する。
※5 AMP-PNP
ATPの三つのリン酸の中の二番目のリン酸と三番目のリン酸が酸素ではなく窒素で連結した非分解性のATP類似体。
- ※6 ミリストイルAMP
炭素数14個の長鎖脂肪酸であるミリスチン酸がAMPとアシル結合した物質。
- ※7 ドメイン
タンパク質の構造単位でコンパクトに折り畳まれたペプチド鎖の塊。
|
<本研究に関する問い合わせ先> 主任研究員 宮野 雅司 独立行政法人理化学研究所 播磨研究所 (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- 脂肪酸代謝システムの鍵となるタンパク質の構造を解明(トピック)