多剤耐性菌感染症の原因となる異物排出タンパクの薬物排出機構に新発見! − 多剤耐性菌感染症を克服する分子標的創薬に向かって大きく前進 −(プレスリリース)
- 公開日
- 2011年11月28日
- BL44XU(生体超分子複合体構造解析)
2011年11月28日
国立大学法人大阪大学
|
国立大学法人大阪大学産業科学研究所の中島良介助教、山口明人教授らの研究グループは、多剤耐性菌感染症の大きな原因である異物排出タンパクの薬物との結合構造を決定することにより、薬物認識・排出機構を解明する画期的な新発見を行いました。抗生物質の発達で克服されたと思われていた細菌感染症が、多剤耐性菌の登場によって再び脅威となっています。なかでも、多剤耐性緑膿菌には有効な臨床治療薬がまだありません。緑膿菌、大腸菌などのグラム陰性細菌の多剤耐性の主原因は異物(多剤)排出タンパクです。異物というのは本来特定できないものです。特定できない異物を、異物排出タンパクはどうやって特異的に認識して排除することができるのかという仕組みは学術上の大きな謎でした。私たちは、異物排出タンパクの分子構造を決定することによりこの仕組みの解明を進めてきましたが、今回、大型放射光施設SPring-8生体超分子複合体構造解析ビームライン(BL44XU)を用いて新たに大分子量の薬物との結合構造の決定に成功し、異物排出タンパクが多様な薬剤を認識する結合ポケットを複数持っており、これらのポケットを次々と受け渡して薬物が輸送されるペリスタポンプ機構という新しい仕組みを発見しました。阻害剤を分子設計する標的の構造が明らかになったことにより、多剤耐性菌感染症を克服する治療薬の分子標的創薬に向かっても大きく前進しました。 (論文) |
発表内容
異物排出タンパクは、生命の誕生と同時に必要とされた、細胞レベルのもっとも基礎的な生体防御装置です。抗生物質の多用により、この根源的な生体防御装置の昂揚を引き起こしてしまったというのが多剤耐性菌問題の本質です。異物排出タンパクは、細胞にとって有害な非常に幅広い範囲の薬物や毒物を識別し排除します。異物というのは本来非特異的なものです。非特異的なものをタンパク質がどうやって特異的に認識するのか。これは現代生物学への大きな挑戦です。異物認識で皆さんが思い浮かべるのは免疫システムだと思います。これは、豊富な遺伝子資源を背景に、遺伝子のシャッフルという手法で、抗体の無限とも言えるバリエーションを作り出し、特異的な抗体で非特異的な異物を認識する壮大なシステムで、高等生物にのみ許された贅沢なシステムです。しかし、細胞はその発生当初から、外部の有害物から自らを守るために、能動的な異物排出ポンプが必須でした。その存在が認識されるようになったのはしかしごく最近のことです。1980年代に、多剤耐性菌や多剤耐性がん細胞の原因となる多剤排出タンパクという形で見つかりました。それまでは、細胞膜が透過障壁となって異物の侵入をブロックしていると考えられていました。しかし、細胞膜の主たる構造は脂質二重層という液晶です。これは特に疎水性、両親媒性の物質に対しては十分に透過障壁とはなりません。能動的異物排出ポンプとセットになって初めて透過障壁は完全なものになるのです。ではこの単一のタンパク質でできている異物排出タンパクがどうやって多種多様の異物を識別・認識し排出できるのか。これが大きな謎でした。
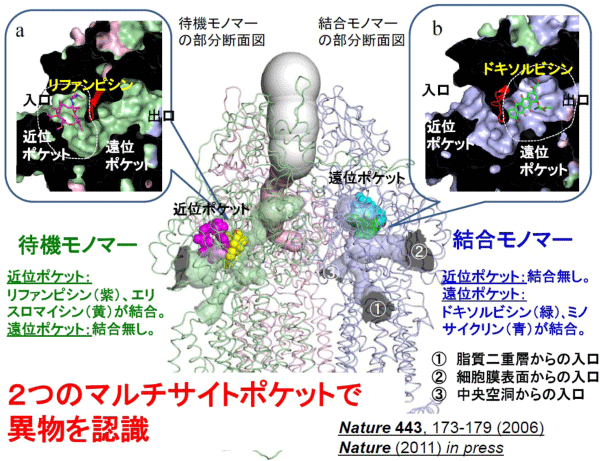
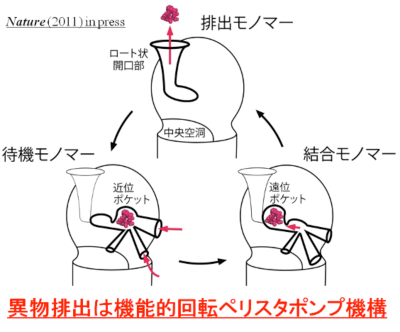
私たちは、2002 年に世界で初めて、細菌異物排出タンパクの結晶構造決定に成功し、異物排出タンパクは細胞質膜の脂質二重層から異物を排出していること、異物の識別は脂質二重層という場の認識であることを明らかにしました。さらに、2006年には薬物との結合構造を解き、多剤の認識が、異物の部分構造を認識する多数のくぼみ(ピット)の組み合わせにより達成されているというマルチサイト結合を明らかにしました。新たに大分子量薬物との結合構造決定に成功し、マルチサイト結合ポケットがもう一つあることを発見しました。2つのマルチサイト結合ポケットは基質の輸送経路に沿って縦に並んでおり、薬物はこのポケットを次々に順送りされて排出されます(ペリスタポンプ機構)。2つのポケットで認識される薬物は異なっているので、マルチサイト結合ポケットが2つあることで認識される異物の範囲が格段に広くなります。
有効な異物排出タンパク阻害剤を構造に基づいて設計するためには、基質結合部位の正確な構造を知らねばなりません。今回、基質結合・輸送経路の全貌が初めて明らかになったことにより、構造を元にした分子標的創薬の展望が大きく開けました。
発表者
山口明人(大阪大学 産業科学研究所 教授) 中島良介(大阪大学 産業科学研究所 助教)
櫻井啓介(大阪大学 産業科学研究所 特任助教) 山崎聖司(大阪大学 産業科学研究所 院生)
西野邦彦(大阪大学 産業科学研究所 准教授)
《参考資料》
図1. 今回決定した大分子量薬物結合AcrB構造はこれまでの遠位結合ポケットに加えて、もう一つの近位マルチドラッグ結合ポケットの存在を明らかにした。基質認識スペクトルの異なる2つのマルチドラッグ結合ポケットの存在により基質の範囲が飛躍的に拡大する。
図2. 薬物は「待機」段階で近位ポケットに入り、大分子量薬物はここで認識され、「結合」段階で遠位ポケットに送り込まれる。小分子量薬物は遠位ポケットで認識される。両ポケットの薬物認識スペクトルは異なる。
|
《問い合わせ先》 (SPring-8に関すること) |
- 現在の記事
- 多剤耐性菌感染症の原因となる異物排出タンパクの薬物排出機構に新発見! − 多剤耐性菌感染症を克服する分子標的創薬に向かって大きく前進 −(プレスリリース)