細菌の大規模改変を可能にする新技術の確立 ~巨大分子輸送ABCトランスポーターの全構造と輸送機構を解明~(プレスリリース)
- 公開日
- 2015年07月31日
- BL38B1(構造生物学III)
- BL41XU(構造生物学I)
- BL44XU(生体超分子複合体構造解析)
2015年7月31日
国立大学法人 京都大学
学校法人常翔学園 摂南大学
|
1.背景 <論文タイトルと著者> |
2.研究手法・成果
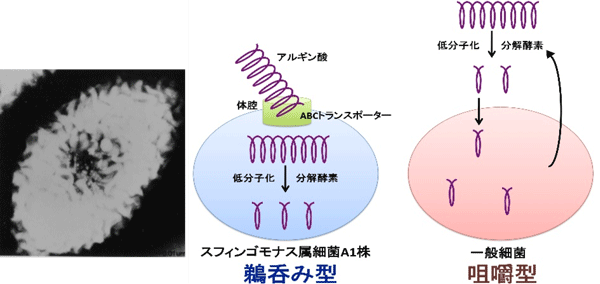
グラム陰性細菌であるA1株は、細胞表層に形成する大きな孔(「
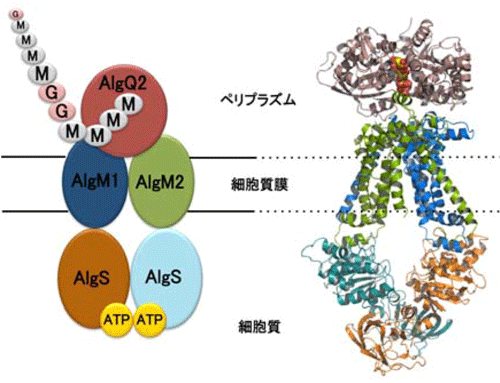
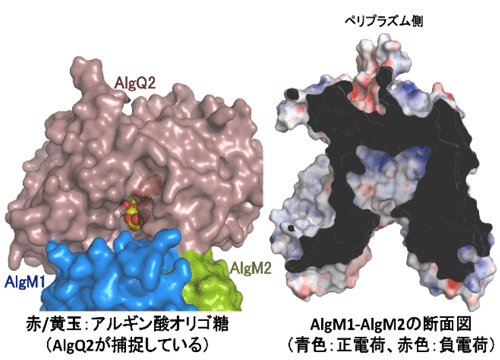
そこで、本研究では、アルギン酸存在下で、結合タンパク質(AlgQ2)とABCトランスポーターが会合して形成する複合体の結晶を調製し、その立体構造をSPring-8のBL38B1, 41XU, 44XUを用いたX線結晶構造解析により決定しました(図2右)。その結果、これまでのABCトランスポーターには見られない特徴的な構造を見出すに至りました。具体的には、結合タンパク質とABCトランスポーターとの界面に長いトンネル構造が認められ、その先端には結合タンパク質に捕捉されたアルギン酸が見出されます(図3左)。つまり、長鎖の巨大分子(多糖類)であるアルギン酸が、このトンネル構造を介して輸送される新規な機構を明らかにしました。さらに、ABCトランスポーターの内腔には、電荷を帯びたアミノ酸残基が配置されており(図3右)、これらの残基が酸性高分子であるアルギン酸の輸送に重要であることも明らかにしました。
つまり、本研究では、巨大分子(多糖類)の取り込みに関わる輸送装置(巨大分子輸送ABCトランスポーター)の新規な立体構造とそれにより巨大分子が細胞内に取り込まれる機構を明らかにしました。
3.学術的意義と波及効果
様々な物質の輸送に関わるABCトランスポーターの立体構造の解明は、生物学上極めて重要ですが、従来、その研究は低分子物質の輸送に関わる極少数のABCトランスポーターに限定されていました。その理由として、ABCトランスポーターは膜タンパク質を含み、且つ数種類のタンパク質から成る複雑な構造をしているため、結晶の調製やその立体構造の決定が困難であることがあげられます。今回、そうした困難を克服し、かつ従来のような低分子物質ではなく、巨大分子(多糖類)の輸送に関わるABCトランスポーターの立体構造を世界で初めて決定しました。この成果は、ABCトランスポーターの物質輸送における理解を格段に進展せしめる大きな学術的意義をもつと考えられます。
本研究成果の応用的、社会的効果も見逃せません。海洋バイオマスの利活用の観点から、既に細菌A1株を用いたアルギン酸からのバイオエタノールの生産に成功しています(Energy & Environ. Sci., 2011)。今回、アルギン酸輸送ABCトランスポーターの構造を決定したことにより、その輸送機能の強化と制御が可能となり、海洋バイオマスからのバイオ燃料生産性の向上が期待されます。また、細菌A1株がもつ輸送系(
4.今後の予定
今回、巨大分子(アルギン酸)がABCトランスポーターによって輸送される最初の段階を世界で初めて明らかにしました。今後は、巨大分子がABCトランスポーターの中をどのように通過して行くか、より詳細な機構を明らかにする予定です。また、
参考図
左:A1株(
中:A1株は、口(
右:一般細菌は、細胞外で巨大分子を分解し、低分子化した物質を取り込む(咀嚼型)
左:アルギン酸結合タンパク質(AlgQ2)とABCトランスポーター(四量体:AlgM1-AlgM2/AlgS-AlgS)]の複合体の構造モデル
右:決定した複合体(左)の立体構造)
左:結合タンパク質(AlgQ2)とABCトランスポーターとの界面に横たわるトンネル構造と結合タンパク質の突きあたりまで入り込んだアルギン酸(中央の黄色)を示す。
右:ABCトランスポーターの断面(黒影の部分)。その背後の空間にアルギン酸と相互作用するアミノ酸が配置されている。
(Nature Biotechnology, 24,188(2006))
<用語解説>
アルギン酸:
褐藻類が産生する細胞間粘質物質。グルロン酸Gとマンヌロン酸Mからなるヘテロ多糖。
グラム陰性細菌:
細胞表層に二枚の膜構造をもち、その間にペリプラズム空間がある細菌。
ABCトランスポーター:
ATPの加水分解により生じるエネルギーを用いて物質を輸送する分子装置。
器官移植:
細胞の構造体や組織をそのまま他の細胞に移す技術。ヒトの臓器移植に相当する。
<お願い>
この研究の内容および図や写真に関しては、下記までご連絡ください。
|
<問合せ先> 京都大学大学院農学研究科 (広報に関すること) 学校法人常翔学園 広報室(摂南大学担当) (SPring-8に関すること) |
- 現在の記事
- 細菌の大規模改変を可能にする新技術の確立 ~巨大分子輸送ABCトランスポーターの全構造と輸送機構を解明~(プレスリリース)