SPring-8 NEWS 88号(2016.9月号)
|
目次 研究成果 · トピックス SPring-8の利用をご検討中の皆様へ SPring-8で学ぶ学生たち お知らせ・行事予告 |
|

取り残されていたToll様受容体の立体構造をついに解析
Tollは、ショウジョウバエの発生において背と腹の軸を決定する遺伝子として1985年に発見されました。この遺伝子を発見した研究者が思わず「toll !」(ドイツ語で「すごい」という意味)と叫んだことが、そのまま名前になったそうです。1996年、Toll遺伝子に変異があるショウジョウバエは、カビに感染して死んでしまうことが分かりました。Toll遺伝子には、カビの感染から体を守る機能もあるのです。さらに1997年、Toll遺伝子に似た塩基配列を持つ遺伝子がマウスで見つかりました。その遺伝子からつくられるタンパク質がToll様受容体(以下、TLR)です。「マウスやヒトなど哺乳類のTLRは、病原体から体を守る免疫システムのうち、自然免疫において非常に重要な働きをしていることが分かってきました」と東京大学教授の清水敏之さんは言います。
病原体を認識するセンサー
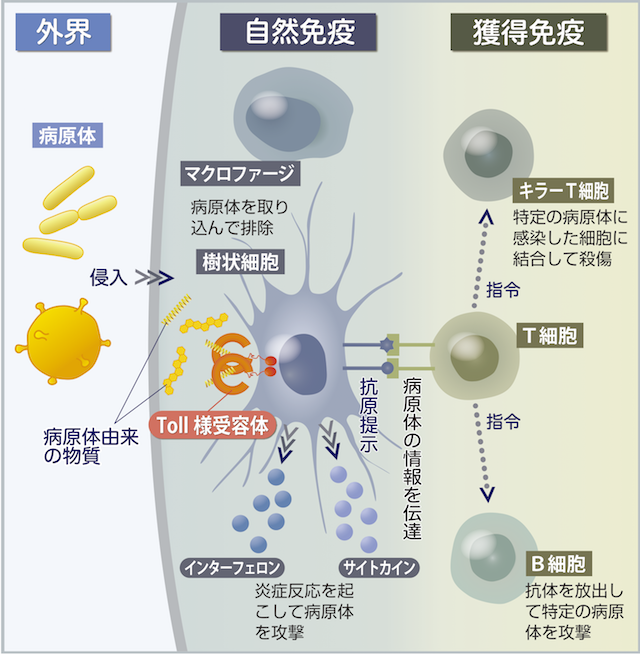
私たちの周りにはウイルスや微生物などの病原体がたくさんあります。病原体が体内に入ってくると疾患を引き起こします。そうならないために、生物には何重もの防御機構が備わっています(図1)。
まず、病原体を体内に入れないことが重要です。病原体を皮膚で跳ね返し、涙や鼻水で洗い流します。しかし、そうした物理的な防御を擦り抜けてしまうものがいます。そこで働くのが、食細胞やリンパ球などのさまざまな免疫細胞で構成される免疫システムです。病原体が体内に侵入すると、自然免疫が働き出し、マクロファージや樹状細胞などの食細胞が、病原体を捕食します。一方で、樹状細胞は食べた病原体の断片を細胞の外に掲げてリンパ球のT細胞に病原体の情報を伝えます。すると獲得免疫が働き出し、キラーT細胞やB細胞などのリンパ球が特定の病原体を強力に攻撃します。
「自然免疫はあらゆる病原体を攻撃します。だから、食細胞は手当たり次第に病原体を食べているだけだと考えられていました。ところが食細胞は、どんな病原体であるかを認識して自然免疫反応を活性化し、サイトカインというタンパク質を放出して病原体を攻撃していることが分かってきました。病原体を認識する自然免疫の代表的なセンサーがTLRです」と清水さんは説明します。
TLRは1997年に報告されて以来、さまざまな生物で次々と見つかり、ヒトでは10種類が知られています。それぞれ認識するものが異なり、例えば、TLR4はリポ多糖、TLR5は細菌の鞭毛を構成するフラジェリン、TLR3は2本鎖RNA、TLR7とTLR8は1本鎖RNA、TLR9はCpG配列を含むDNA(CpG DNA)を認識します。CpG配列とは、塩基のシトシン(C)とグアニン(G)がホスホジエステル結合でつながったものです。
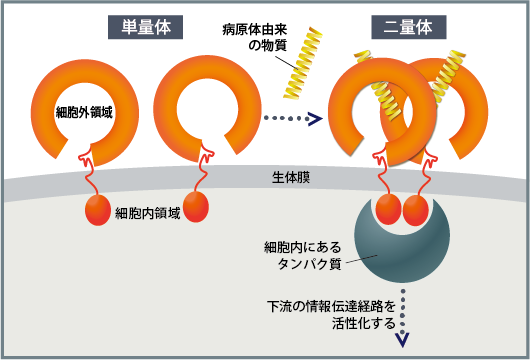
TLRは細胞膜にあり、外に出ている馬蹄形の細胞外領域と、中にある細胞内領域から構成されます。何も結合していないTLRは分子1個の単量体で存在しています。病原体由来の物質が結合すると、2個の分子が結合した2量体になり活性化します。すると細胞内領域にタンパク質が結合し、「こういう病原体が侵入したぞ」という情報が伝達され、自然免疫の反応が起きるのです(図2)。
「TLRがそれぞれ何を認識するのかが分かってくると、次はそれがTLRとどのように結合し、認識するのかを知りたくなります。そのためには立体構造を詳しく調べることが近道です」と清水さんは解説します。「TLRの立体構造は、2007年くらいから次々と解析されてきました。そうした中で立体構造が不明なまま残されていたのが、TLR7、TLR8、TLR9でした。私たちは、それらの立体構造を明らかにすることを目指しました」
予想外の方法で1本鎖RNAを認識
TLR7~9とTLR3は細胞内のエンドソームという小器官の表面に存在しています。核酸であるRNAやDNAを認識するという共通点もあります。「TLR7〜9のいずれも2000年前後に存在を確認されていながら10年以上も立体構造が解明されず、もう見ることはできないのではないかと諦めムードが漂っていました。ギブアップしたという話は何人もの研究者から聞きました」と清水さん。
そうした中、清水さんたちはついに2013年にTLR8と人工低分子の複合体、続いてTLR8と1本鎖RNAの複合体について立体構造の解析に成功しました。「解析結果を見て、とても驚きました」と清水さん。解析結果を見ると、TLR8に結合しているはずの長い1本鎖RNAが見当たらなかったのです。調べてみると、ウリジンというRNAに特有の物質と、1本鎖RNAが分解してできた短いオリゴヌクレオチドが、TLR8の別の部位に結合していました。「RNAが分かれて2カ所で結合しているとは、誰も考えませんよ」と清水さんは苦笑します。この成果は大きな注目を集めました。
TLR9の構造解析は苦難の連続
そして2015年2月、清水さんたちはTLR9の構造解析にも成功しました。この研究の中心となった准教授の大戸梅治さんは、こう言います。「実は、構造解析を始めたのはTLR8より早かったのですが、苦戦していました。ようやく解析できてホッとしました」
どういう点で苦労したのでしょうか。「X線結晶構造解析を行うには、構造を知りたいタンパク質をたくさんつくり、それがきれいに並んだ大きな結晶をつくらないといけません。ところが、結晶に必要なTLR9のタンパク質をつくれなかったのです」と大戸さん。タンパク質解析を行う場合は普通、そのタンパク質の遺伝子を大腸菌や酵母などに導入してつくらせます。「あらゆる細胞を試しても駄目でした。たまたまタンパク質の発現にはあまり使われないS2というショウジョウバエ由来の細胞を使ってみたら、ようやくTLR9がつくれるようになりました」
これでうまくいくかと思われましたが、ヒトのTLR9は十分な量がつくれませんでした。そこで、サルやウマなど7種類の生物のTLR9を試しました。種によってアミノ酸配列や性質は少しずつ違いますが、CpG DNAを認識するという根本的な機能は同じです。最終的に、ウマとウシとマウスのTLR9について構造解析を行うことにしました。
ところが、TLR9と微生物由来のCpG DNAと反応させても、TLR9が活性化しないのです。「また途方に暮れました」と大戸さん。解決のヒントはTLR8にありました。「TLR8とTLR9にはZループと呼ばれる構造があります。活性化されているTLR8では、そのZループが切れていました。そこでTLR9のZループをあらかじめ切ったら、無事、活性化されました」
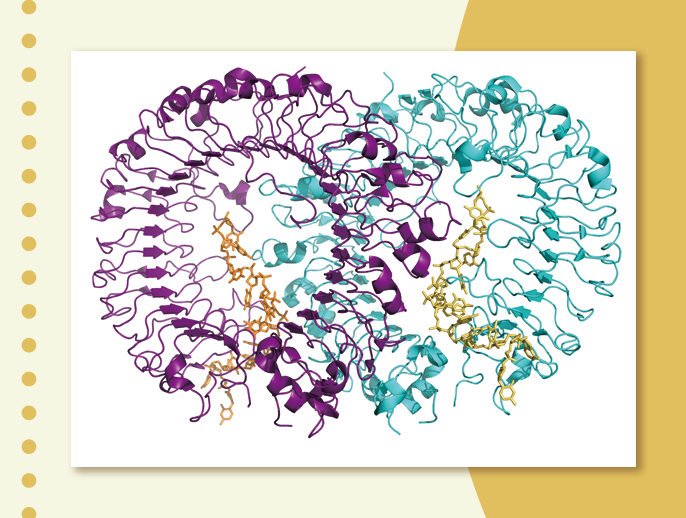
こうして、ようやくできたTLR9とCpG DNAの複合体の結晶をSPring-8の構造生物学ビームラインBL41XUで解析しました(図3)。「結晶は100 µm(0.1 mm)と小さく、十分な大きさではなかったのですが、1.6 Åという非常に高い解像度のデータを取ることができました。X線が高輝度で非常に強く、高い平行性を持ったSPring-8でなければ、これほどの高解像度での構造解析は難しかったでしょう」と大戸さんは言います。TLR9とCpG DNAは2対2の比率で結合して、2量体を形成していました。CpG DNAはTLR9の溝にはまり込むことで認識されるというメカニズムも明らかになりました。
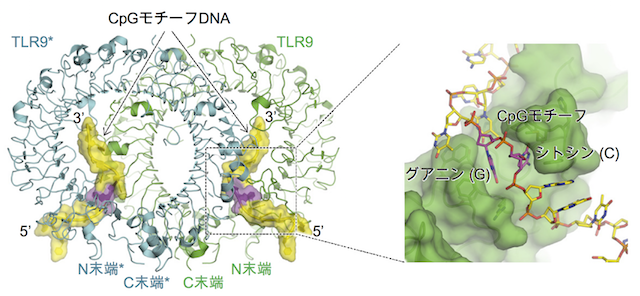
TLR9とCpG DNAは2対2の比率で結合して2量体の活性化型を形成する。
CpG DNAはTLR9の溝に結合している。右は、溝の拡大図。
TLR9の機能を抑制するDNA配列(アンタゴニストDNA)とTLR9の複合体の構造解析も行いました。その結果、アンタゴニストDNAとCpG DNAの結合領域は一部重複していて、CpG DNAの結合を邪魔することでTLR9の機能を抑制していることが分かりました。なぜ抑制についても調べたのでしょうか。「免疫は活性化した方がいいと思われがちですが、過剰な活性化は自分を攻撃してしまう自己免疫疾患を引き起こします。免疫は活性化と抑制のバランスが重要で、抑制メカニズムの理解も欠かせません」と清水さんは指摘します。
清水さんたちは、すでに次の目標に向かって動き出しています。「まずは残っているTLR7を片付けてしまいたいですね」と大戸さん。清水さんは、「TLRについては、細胞外領域と細胞内領域が結合した状態での構造解析はまだできていません。それをぜひやりたいです」と意気込みます。そして「私たちは薬学系に所属していますから、創薬に結び付けることも常に意識しています」とも語ります。TLR8やTLR9の構造解析から得られた知見は、抗ウイルス薬やアレルギー薬、ワクチンなどの開発につながると期待されています。

諦めなかった理由
TLR8やTLR9の構造解析は、水面下で激しい競争が繰り広げられていました。「先を越されたらどうしようと、毎日ドキドキしていました」と清水さん。脱落していくライバルもいる中、なぜ諦めずに続けたのでしょうか。「せっかく始めたのだから、絶対に構造を見てやろうという意地ですね」と大戸さんは笑います。「誰も見ていないものを見るってワクワクするでしょう。どんな形をしているのか見たい。その一言に尽きます」と語る清水さんは、実は有機化学をやりたかったそうです。「化学実験の才能がなくて諦めました。構造生物学に進み、初めて解析したタンパク質の形がとても美しかった。それで、この世界にはまってしまいました」
構造生物学に向いているのはどういう人かと聞くと、「粘り強い人」と声が揃いました。とはいえ、煮詰まることもあります。走ることで気分転換し、学生時代からのブランクを破ってフルマラソンへの挑戦を密かに狙っている大戸さん。愛犬との散歩でリフレッシュしているという清水さん。次は、どんなタンパク質の形を見せてくれるのでしょうか。

研究室にて。清水さん(左)と大戸さん(右)
文:フォトンクリエイト 鈴木 志乃
この記事は、東京大学大学院薬学系研究科蛋白構造生物学教室の清水敏之教授と、大戸梅治准教授にインタビューして構成しました。

タンパク質の結晶構造解析
SPring-8では7本のビームラインで、タンパク質など巨大分子の結晶回折測定ができます。ここでは共用ビームラインBL41XUとBL38B1を主に紹介します。
BL41XUは、アンジュレータの高輝度X線ビームを生かして、10 µmサイズの微小結晶から、より大きな結晶まで測定できる高精度迅速測定用ビームラインです(図1)。膜タンパク質の結晶など微小なために解析が困難とされる試料に威力を発揮しています。
また、高速化も実現し1試料3分程度で測定が完了します。25-35 keVの短波長X線による超高分解能(〜0.4 Å)測定も可能で、幅広く難度の高い試料の高精度測定に対応しています。
BL38B1は、偏向電磁石光源を用いたビームラインで、異常分散測定や試料環境を変化させる計測などさまざまな測定に対応します。独自開発の温湿度調整装置により、室温から低温まで試料雰囲気を変えながら測定ができます。また、オンライン顕微分光装置により、結晶中の化学状態の変化を分光学的にモニターしながら、回折を測定することもできます。そのほか、利用者がSPring-8に来られない場合のために測定サービスを行っているほか、インターネットを介した遠隔測定も可能です。
このほか、課題を申請して利用できる理研ビームラインとして、1 µmサイズの超高輝度ビームが利用できるBL32XUと、自動化に特化したBL26B1/BL26B2があります。さらに、大阪大学蛋白質研究所ビームラインBL44XUは超分子複合体に最適化されており、独自に課題を受け付けています。

一般に“結晶”は高密度かつ高い規則性をもって原子や分子が凝集したもので、宝石や氷砂糖のように硬く安定な状態を保っています。しかし、タンパク質の結晶は体積の半分ほどが水分であり、乾燥や衝撃にはとても弱く、さらに水から取り出すと容易に壊れてしまいます。このため、図2のような装置や道具を使って、水分ごと極低温で凍結した状態で扱うのが一般的です。どのビームラインにも吹付低温装置と低温試料を扱える試料交換ロボットが装備されています。しかし、最近では本来タンパク質が機能している室温付近での解析も見直されており、図3のような湿った気流を試料に吹き付ける装置も開発しています。
SPring-8の利用事例や相談窓口については、こちらをご覧ください。

第3回:岡山大学 Xieさん
今回は岡山大学のXieさんです。SPring-8の大学院生提案型課題を利用して、自ら課題申請と実験を行っています。
Q.SPring-8でどのような研究をしていますか?
A.初期地球におけるプレート活動を鉱物物理の立場から解明するため、SPring-8 BL04B1の高温高圧発生装置を利用して、ケイ酸塩メルトの粘性を高温高圧下で計測しています。
Q.出身と現在岡山大学にて学んでいる経緯を教えて下さい。
A.出身は中国江西省吉安市にある井岡山市(せいこうざん-し)です。
中学時代から物質科学を中心とした理系分野に興味があり、その頃から研究者を目指していました。出身大学は中国地質大学武漢校です。岡山大学の惑星物質研究所へはインターシッププログラムで修士学生のときに訪れました。そのときに世界トップクラスの研究に触れて感動し、「ここで学位をとろう」と修士課程を中退して留学してきました。
Q.SPring-8についての印象は?
A.研究者もスタッフも皆さん優しいです。毎回、懇切丁寧に実験に付き合っていただいています。外国人が多いのも特徴だと思います。
Q.どのような信念を持って研究していますか?
A.“一分耕転、一分収穫(努力なくして収穫なし)”です。何事にも真摯に取り組みたいです。
インタビューの中で「好きな日本食は?」との質問に「指導教員の米田先生が作った日本式カレーライス」と答えをくれたXieさん。研究では、自ら実験に使う装置の開発もされているそうです。放射光利用を通じて世界を“またにかける”研究者として活躍してほしいですね。
※川井型高圧発生装置についてはSPring-8 News No.76で紹介しています

第16回 SPring-8夏の学校~最先端の放射光科学を学ぶ~
“SPring-8夏の学校”は、SPring-8を教育の場として活用する機関が主催し、「将来の放射光利用研究者の発掘と育成」を目的として開催され、今年は16回目を迎えました。
7月3日(日)〜7月6日(水)の3泊4日の日程で開催され、日本全国から昨年度の参加者数を上回る91名の博士前期(大学院修士)課程と学部4年の学生が集まりました。期間中には7講座の講義、SPring-8の実験ホールとマシン収納部やSACLAの見学、各参加者2テーマのビームライン実習が行われ、参加者たちが熱心に取り組む姿が見られました。
放射光を用いた研究は多分野に及び、参加者の専攻分野も幅広く、物質・生命科学分野だけではなく文化財を研究する学生なども参加し、皆一丸となり講習や実験に励んでいました。そのような中で大学の授業では得られないような、広範な知識と技術を得られる点こそが、夏の学校の大きな特長となっています。受け入れ側も、“夏の学校史上最多”の参加者の中で、大きな事故もなく終了し、最終日は安堵の表情で参加者を見送りました。これからのSPring-8を含む放射光を利用した研究の発展には、新たな人材の育成が必須であり、参加者がこの“夏の学校”を機に、放射光を扱う研究に進んでもらうことが、主催者としての開催意義と考えています。
(SPring-8夏の学校実行委員会 事務局)