巨大ヘモグロビンの結晶構造の解明に成功 (プレスリリース)
- 公開日
- 2005年10月04日
- BL38B1(構造生物学III)
- BL41XU(構造生物学I)
- BL44XU(生体超分子複合体構造解析)
- BL45XU(理研 構造生物学I)
平成17年10月4日
京都大学
理化学研究所播磨研究所
|
京都大学大学院理学研究科の三木邦夫教授、沼本修孝研究員は、金沢大学大学院自然科学研究科の福森義宏教授、中川太郎研究員、金沢大学自然計測応用センターの笹山雄一教授、理化学研究所播磨研究所との共同で、口や消化管が存在せず、主として体内に共生させた細菌から有機物などの栄養源を獲得して生きているマシコヒゲムシという動物に存在する巨大なヘモグロビンの立体構造の決定に世界で初めて成功し、このような無脊椎動物のヘモグロビンがとる超分子構造を分子レベルで詳細に解明しました。これは、現在、文部科学省で推進している「タンパク3000プロジェクト」ならびに科学研究費・特定領域研究「生体超分子構造」での研究成果の一つです。 (論文) |
1.背景
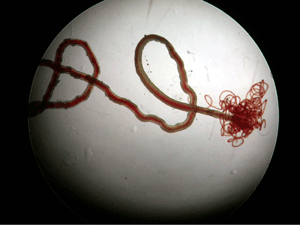
ヘモグロビンは動物の体内で酸素運搬の機能を担っている、極めて重要なタンパク質です。ヒトをはじめ、ほとんどの脊椎動物では、ヘモグロビンは4つのサブユニットからなるタンパク質複合体(分子量約64,500)として赤血球中に存在しており、こでまで、その立体構造と機能の関係には多くの詳細な研究があります。これに対し、ある種の無脊椎動物には、その分子量が数十万から数百万にも達する、極めて巨大な複合体を形成するヘモグロビンがあります。石川県能登半島の九十九湾海底には、有鬚(ゆうしゅ)動物門に属するマシコヒゲムシ(Oligobrachia mashikoi)と呼ばれる、世界的にも珍しい生物が生育しており(図1)、このマシコヒゲムシの血液中には、分子量約40万の巨大なヘモグロビン複合体が存在しています。マシコヒゲムシは、動物であるにもかかわらず、口や消化管が存在せず、もっぱら体内に共生させた細菌から有機物などの栄養源を獲得して生きています。マシコヒゲムシのもつ巨大へモグロビン複合体は、脊椎動物のヘモグロビンと同様に酸素を運搬するだけではなく、共生細菌のエネルギー源である硫化水素も同時に運搬し、このような特徴的に異なる機能を、一つのタンパク質で実現していることに興味が持たれていました。しかしながら、血液中に存在するこのような巨大ヘモグロビンについての立体構造の詳細や、通常は猛毒である硫化水素を無害な状態で運搬するメカニズムについては明らかになっていませんでした。
2.研究成果の概要
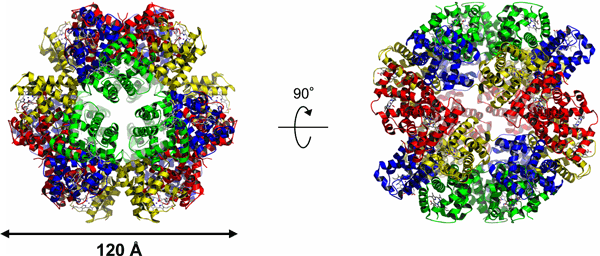
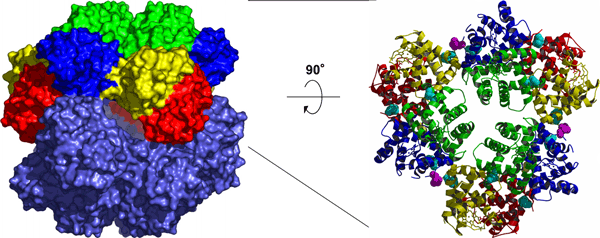
研究グループでは、マシコヒゲムシの巨大へモグロビン複合体の結晶化をし、大型放射光施設(SPring-8)(構造生物学IIIビームラインBL38B1、構造生物学IビームラインBL41XU、生体超分子複合体構造解析ビームラインBL44XU、理研構造生物学IビームラインBL45XU)を使ってその立体構造の解明に成功しました。マシコヒゲムシの巨大へモグロビンは、4種類のサブユニットからなる24量体を形成しており、外径約120Å、内部に直径約50Åの空洞が存在する球状構造であることが明らかになりました(図2)。さらに球状構造をふたつに割ったものに相当する、12量体の構造(図3)は、ヒゲムシと近縁の他の動物がもつ巨大へモグロビン複合体のものと共通のユニット構造であることも明らかとなりました。また、今回の研究により得られた立体構造から、硫化水素を結合すると予想される部位の周辺環境が明らかになり、とくに硫黄原子を持つシステイン残基と芳香族アミノ酸のフェニルアラニン残基が、硫化水素結合の際に大きく貢献している可能性が解明されました。これらの成果から、複雑な会合状態をとる超分子タンパク質複合体の形態形成のメカニズム解明に、無脊椎動物のヘモグロビンについての進化上の考察に、また、猛毒の硫化水素を無害化し、共生細菌に引き渡すという生物学上非常に興味深い機能の解明に対して、重要な知見となることが期待されます。
<参考資料>
|
<本研究に関する問い合わせ先> <SPring-8についての問い合わせ先> |
- 現在の記事
- 巨大ヘモグロビンの結晶構造の解明に成功 (プレスリリース)